دوره 24، شماره 6 - ( بهمن و اسفند 1400 )
جلد 24 شماره 6 صفحات 867-854 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghanipour F, Nazari R, Aghaee S S, Jafari P. Evaluation of the Antimicrobial Ability of Probiotics Against Nosocomial Infections by Inhibiting Ompa Gene Expression in Acinetobacter Baumannii. J Arak Uni Med Sci 2022; 24 (6) :854-867
URL: http://jams.arakmu.ac.ir/article-1-7019-fa.html
URL: http://jams.arakmu.ac.ir/article-1-7019-fa.html
غنی پور فرنگیس، نظری راضیه، آقایی سید سهیل، جعفری پروانه. بررسی قابلیت ضدمیکروبی پروبیوتیکها علیه عوامل عفونتهای بیمارستانی از طریق مهار بیان ژن ompA دراسینتوباکتربومانی. مجله دانشگاه علوم پزشكي اراك. 1400; 24 (6) :854-867
فرنگیس غنی پور1 

 ، راضیه نظری2
، راضیه نظری2 

 ، سید سهیل آقایی1
، سید سهیل آقایی1 

 ، پروانه جعفری3
، پروانه جعفری3 




 ، راضیه نظری2
، راضیه نظری2 

 ، سید سهیل آقایی1
، سید سهیل آقایی1 

 ، پروانه جعفری3
، پروانه جعفری3 


1- گروه میکروبیولوژی، دانشکده علوم پایه، واحد قم، دانشگاه آزاد اسلامی، قم، ایران.
2- گروه میکروبیولوژی، دانشکده علوم پایه، واحد قم، دانشگاه آزاد اسلامی، قم، ایران. ،r.nazari1102002@gmail.com
3- گروه میکروبیولوژی، دانشکده علوم پایه، واحد اراک، دانشگاه آزاد اسلامی، اراک، ایران.
2- گروه میکروبیولوژی، دانشکده علوم پایه، واحد قم، دانشگاه آزاد اسلامی، قم، ایران. ،
3- گروه میکروبیولوژی، دانشکده علوم پایه، واحد اراک، دانشگاه آزاد اسلامی، اراک، ایران.
متن کامل [PDF 4399 kb]
(1483 دریافت)
| چکیده (HTML) (3567 مشاهده)
متن کامل: (2258 مشاهده)
مقدمه
امروزه عوامل شیمی درمانی ضدمیکروبی به طور وسیعی برای کنترل عفونتهای مختلف به کار گرفته میشوند. در حال حاضر، به دلیل پیدایش سویههای مقاوم به آنتیبیوتیکها و اثرات جانبی آنها استفاده از این داروها چندان رضایتبخش نیست. همواره محققین به دنبال یافتن راهکارهای جدید برای حل این مشکل هستند که در این راستا پروبیوتیکها از اقبال خوبی برخوردار بودهاند [1 ,2]. باکتریهای پروبیوتیک از جمله باسیلوسها با تولید انواع ترکیبات مهارکننده علیه گونههای باکتریایی گرم مثبت و گرم منفی خواص ضدمیکروبی خود را اعمال میکنند و به عنوان یک روش درمانی در برخی از بیماریها مورد استفاده قرار گرفته وکاربردهای وسیعتری نیز برای آنها در آینده قابل پیشبینی است. گلناری و همکاران در یک مطالعه خاصیت ضدمیکروبی سویههای باسیلوس را بر علیه پاتوژنهای مقاوم به آنتیبیوتیک مورد بررسی قرار دادند و شاهد مهار رشد پاتوژنها با استفاده از سوپرناتانت باسیلوسها بودند [3 ,4 ,5]. عفونت بیمارستانی یکی از دلایل اصلی مرگ و میر و افزایش دوره نقاهت در بیماران است که اغلب توسط عوامل مقاوم به آنتیبیوتیک ایجاد میشود. اسینتوباکتربومانی یک باسیل گرم منفی، هوازی مطلق، غیر تخمیری و بیماریزای فرصتطلب است که قادر به ایجاد انواع عفونتهای بیمارستانی از جمله پنومونی، باکتریمی، عفونت مجاری ادراری و مننژیت در بخشهای مختلف بیمارستان بهویژه بخش مراقبت ویژه است [6, 7, 8]. این باکتری به علت دارا بودن انواعی از عوامل مؤثر در مقاومت آنتیبیوتیکی در باکتریها مانند پمپهای افلاکس، آنزیمهای بتالاکتامازی و توانایی تشکیل بیوفیلم قوی، مقاومتهای بالای آنتیبیوتیکی از خود نشان میدهند و مشکلات متعددی را در بیماران ایجاد میکند [9, 10]. توانایی تشکیل بیوفیلم در اسینتوباکتر بومانی بهعنوان یکی از فاکتورهای اصلی ویرولانس درنظر گرفته میشود که علاوه بر توانایی رشد در انواعی از محیطهای بالینی و شرایط محیطی نامناسب، سبب افزایش مقاومت باکتری به عوامل ضد میکروبی و ایجاد عفونت در بیماران میشود [11, 12] .در باکتریهای گرم منفی، یکی از فاکتورهای مؤثر در تشکیل بیوفیلم، پروتئین غشای خارجی به نام پروتئین غشای خارجی A است که در سازگاری و ویرولانس این باکتریها نقش مهمی دارد [14 ،13]. پروتئین غشای خارجی A در اتصال اسینتوباکتر بومانی به سطوح زنده و غیر زنده برای تشکیل بیوفیلم نقش دارد و باعث پایداری بیوفیلم و ایجاد مقاومت آنتیبیوتیکی میشود [15, 16]. باباپور و همکاران با بررسی ارتباط بین مقاومت آنتیبیوتیکی و حضور ژن پروتئین غشای خارجی A در اسینتو باکتر بومانی به این نتیجه رسیدند که تمامی سویههای اسینتوباکتربومانی جدا شده از نمونههای بالینی که دارای مقاومتهای چندگانه آنتیبیوتیکی بودند دارای ژن پروتئین غشای خارجی A هستند [17] نای و همکاران در یک پژوهش عنوان کردند پروتئین غشای خارجی A دارای فعالیتهای بیولوژیکی متنوع مانند اتصال به سلولهای اپی تلیال میزبان، القای مرگ سلول و دخالت در خارج کردن ترکیبات از فضای پری پلاسمی است [18, 19]. بنابراین به دلیل افزایش مقاومتهای آنتیبیوتیکی در اسینتوباکتربومانی مهار تشکیل بیوفیلم از طریق مهار بیان ژنهای مؤثر در تشکیل بیوفیلم و متعاقباً افزایش حساسیت به آنتیبیوتیکها میتواند از اهمیت ویژهای برخوردار باشد. این پژوهش با هدف شناسایی بهترین پروبیوتیک با توانایی مهار رشد و تشکیل بیوفیلم در جدایه اسینتوباکتربومانی با مقاومت آنتیبیوتیکی چندگانه از طریق مهار بیان ژن پروتئین غشای خارجی A مرتبط با تشکیل بیوفیلم در این جدایه انجام شد.
مواد و روشها
بررسی مقاومت جدایهها به اسید و نمکهای صفراوی
مطالعه حاضر بهصورت آزمایشگاهی انجام شد. جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس از دکتر پروانه جعفری در آزمایشگاه تحقیقاتی میکروبیولوژی دانشگاه آزاد اسلامی واحد اراک تهیه شد. برای بررسی مقاومت به محیط اسیدی در جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی [20, 21, 22]، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس [23, 24] و با توجه به شرایط رشد متفاوت این جدایهها، در ابتدا از هر جدایه سوسپانسیون میکروبی با غلظت حدود CFU/ml 109 تهیه شد. سپس 1 میلیلیتر از سوسپانسیون میکروبی به بافر فسفات سالین با حجم 9 میلیلیتر و pH برابر با 2 اضافه شد. برای تنظیم pH از HCL با غلظت 0/1 نرمال استفاده شد. به منظور شمارش تعداد باکتری موجود در سوسپانسیون میکروبی (یک واحد تشکیل کلنی) در زمان صفر، رقت سازی و کشت هر یک از رقتها انجام و گرماگذاری شد (کنترل). در ادامه لولههای حاوی بافر فسفات سالین در دمای 37 درجه سانتیگراد به مدت 3 ساعت گرماگذاری و سپس به محیط کشت انتقال داده و با توجه به شرایط رشد هر جدایه گرماگذاری و کلونیها شمارش شد.
برای بررسی مقاومت جدایهها به نمکهای صفراوی از روش گیلیلند و والکر استفاده شد. درنهایت با استفاده از فرمول ضریب مهار که توسط گوپال و همکاران ارائه شده است، بازدارندگی رشد جدایهها به وسیله نمکهای صفراوی اندازهگیری شد [25, 26].
استخراج سوپرناتانت
جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس با توجه به شرایط رشد اختصاصی خود کشت داده شده و سوپرناتانت آن استخراج شد [27, 28, 29]. سپس به منظور جداسازی پپتیدها با خاصیت ضدمیکروبی هر یک از سوپرناتانتهای استخراج شده، بهطور مجزا درون دکانتور با اتیل استات به نسبت 1:1 ترکیب و فاز رویی که حاوی اتیل استات و پپتیدها با خاصیت ضدمیکروبی احتمالی بود، جداسازی شد. سپس اتیل استات با استفاده از روتاری خشک شد [30].
بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراجشده علیه شاخصهای بیماریزای بیمارستانی
برای بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراج شده از روش آگار ول دیفیوژن استفاده شد. در این روش از میکروارگانسیمهایی نظیر جدایه بیمارستانی اسینتوباکتربومانی 52 A با مقاومت آنتیبیوتیکی چندگانه (جداسازی شده توسط ساریخانی و همکاران از بیمارستانهای قم [31]، اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC و سودوموناس آئروژینوزا PAO1 بهعنوان شاخصهای بیماریزای فرصتطلب بیمارستانی استفاده شد. برای این منظور ابتدا از هر یک از میکروارگانسیمهای مذکور، سوسپانسیون نیم مک فارلند تهیه شد. حجم 60 میکرولیتر از آن بر روی سطح مولر هینتون آگار (مرک، آلمان) انتقال و بهصورت سفرهای کشت داده شد. سپس با استفاده از پیپت پاستور دو چاهک ایجاد شد، ته هر یک از چاهکها با استفاده از سافت آگار پوشیده شد و به یکی از چاهکها 50 میکرو لیتر اتیل استات بهعنوان کنترل و به چاهک دیگر 50 میکرولیتر سوپرناتانت جدایه اضافه و روی چاهکها نیز با سافت آگار پوشیده شد و به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. در مرحله بعد هالههای عدم رشد میکروارگانیسمها در محیط مولر هینتون آگار در صورت مشاهده اندازهگیری شد. این بخش از روش کار به دلیل احتمال خطا برای هر جدایه 3 بار تکرار شد [32].
تعیین حداقل غلظت مهار رشد
از روش میکرودایلوشن برای تعیین حداقل غلظت مهار رشد استفاده شد. در این روش از باکتریهای اسینتوباکتربومانی 19606ATCC به عنوان کنترل و جدایه اسینتوباکتربومانی 52 A استفاده گردید. 50 میکرولیتر محیط مولر هینتون براث به تمام چاهکهای میکروپلیت اضافه شد. سپس در چاهک اول 50 میکرولیتر سوپرناتانت جدایه باسیلوس لیکنی فورمیس با غلظت 2048 میکروگرم بر میلیلیتر (وزن خشک سوپرناتانت) اضافه شد. سپس 50 میکرولیتر از چاهک اول برداشته به چاهک دوم و به همین ترتیب تا چاهک 10 که 50 میکرولیتر دور ریخته شد. 50 میکرولیتر سوپرناتانت به چاهک 12 اضافه و چاهک 11 کنترل مثبت و چاهک 12 کنترل منفی در گرفته شد. با استفاده از باکتریهای مذکور، سوسپانسیون نیم مک فارلند تهیه و به چاهکهای 1تا 11 مقدار 50 میکرولیتر از سوسپانسیون میکروبی اضافه شد. غلظت چاهکهابه ترتیب 1024-512-256-128-64-32-16-8-4-2 میکروگرم بر میلیلیتر بود. سپس میکروپلیت به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. چاهک قبل از حداقل غلظت مهار رشد محسوب میشود [33].
بررسی فنوتیپی مهار بیوفیلم در اسینتوباکتربومانی
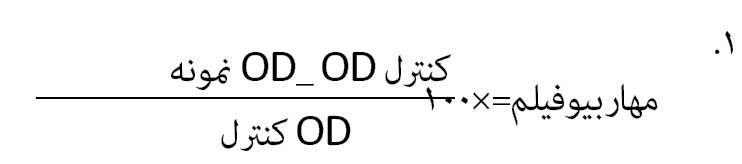
در مرحله بعد برای بررسی فنوتیپی مهار بیوفیلم با استفاده از باکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A سوسپانسیون نیم مک فارلند تهیه و به درون هر چاهک از میکروپلیت 96 خانه 100 میکرولیتر سوسپانسیون میکروبی اضافه و بر اساس غلظت ساب حداقل غلظت مهار رشد به دست آمده به درون هر چاهک سوپرناتانت جدایه باسیلوس لیکنی فورمیس اضافه شد و به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. در مرحله بعد به هر چاهک کریستال ویوله 1 درصد اضافه شد و بعد از 20 دقیقه چاهکها با الکل اتانول شستشو داده شد. سپس جذب چاهکها با استفاده از دستگاه الایزا ریدر مورد بررسی قرار گرفت. درنهایت، میزان مهار بیوفیلم طبق فرمول شماره 1 محاسبه شد [34]. با استفاده از میکروسکوپ الکترونی رویشی نشر میدانی توانایی تشکیل بیوفیلم در جدایه اسینتوباکتر بومانی 52 A و مهار تشکیل بیوفیلم در این جدایه بعد از تیمار با حداقل غلظت مهار کنندگی سوپرناتانت باسیلوس لیکنی فورمیس مورد بررسی قرار گرفت [35].
شناسایی ژن پروتئین غشای خارجی A مؤثر در تشکیل بیوفیلم در اسینتوباکتربومانی
استخراج ژنوم
برای شناسایی پروتئین غشای خارجی A در ابتدا ژنوم جدایه اسینتوباکتربومانی 52 A با استفاده از روش جوشاندن استخراج شد [31].
پرایمر مورداستفاده در واکنش زنجیرهای پلیمراز
پرایمر اختصاصی مورداستفاده برای شناسایی ژن پروتئین غشای خارجی A در جدول شماره 1 ارائه شده است.
.jpg)
ترکیب مواد و برنامه حرارتی مورداستفاده در واکنش زنجیرهای پلیمراز
واکنش زنجیرهای پلیمراز با حجم نهایی 25 میکرولیتر حاوی 5/13 میکرولیتر مستر میکس 2X، 1 میکرولیتر پرایمر فوروارد، 1 میکرولیتر پرایمر ریورس، 100 نانوگرم ژنوم اسینتوباکتربومانی و 4/5 میکرولیتر آب مقطر استریل انجام شد. سپس با استفاده از دستگاه ترموسایکلر برنامه دمایی شامل دناتوراسیون اولیه 4 دقیقه در دمای 94 درجه سانتیگراد، دناتوراسیون 1 دقیقه در دمای 94 درجه سانتیگراد، اتصال پرایمر اختصاصی ژن پروتئین غشای خارجی A به مدت 1 دقیقه در دمای 53 درجه سانتیگراد، تکثیر به مدت 1 دقیقه در دمای 72 درجه سانتیگراد برای 35 سیکل و تکثیر نهایی به مدت 7 دقیقه در دمای 72 درجه سانتیگراد انجام شد. در ادامه محصول حاصل از واکنش زنجیرهای پلیمراز پس از رنگآمیزی با اتیدیوم بروماید، بر روی آگارز 1درصد الکتروفورز شد (چاهک 4 کنترل منفی) و با استفاده از دستگاه ژل داکمورد بررسی قرار گرفت [31]. درنهایت، محصول حاصل از واکنش زنجیرهای پلیمراز ژن پروتئین غشای خارجی A در جدایه اسینتوباکتربومانی 52 A برای تعیین توالی به شرکت پیشگام ارسال شد.
بررسی بیان ژن موثر در تشکیل بیوفیلم (ژن پروتئین غشای خارجی A) در اسینتوباکتربومانی
برای بررسی بیان ژن در ابتدا حضور ژن پروتئین غشای خارجی A در جدایه اسینتوباکتربومانی 52 A با استفاده از تکنیک واکنش زنجیرهای پلیمراز مورد تأیید قرار گرفت. سپس بیان ژن پروتئین غشای خارجی A در باکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A با استفاده از تکنیک Real Time PCR مورد ارزیابی قرار گرفت. برای تیمار سوسپانسیون جدایه اسینتوباکتربومانی 52 A، این سوسپانسیون همراه با حداقل غلظت مهارکنندگی بیوفیلم از سوپرناتانت باسیلوس لیکنی فورمیس با هم ترکیب شده و 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد.
استخراج RNA از جدایه اسینتوباکتربومانی 52 A و سنتز cDNA
برای این منظور ازباکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A، قبل و بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس استخراج RNA با استفاده از کیت استخراج RNA مطابق دستورالعمل شرکت سازنده، انجام شد و با دستگاه نانودراپ (برای جلوگیری از خطای احتمالی پس از قرار دادن هر نمونه روی حسگر و اتمام سنجش، حسگر با کاغذ صافی تمیز شد) مورد بررسی قرار گرفت. برای سنتز cDNA از کیت (BIOFACT کشور کره جنوبی) مطابق دستورالعمل شرکت سازنده، استفاده شد. این مرحله در حضور رندوم هگزامر پرایمر، آنزیم ترانس کریپتاز معکوس و مخلوط دئوکسی نوکلئوزید تریفسفات و بر طبق برنامه دمایی 5 دقیقه در دمای 25 درجه سانتیگراد، 60 دقیقه در دمای 42 درجه سانتیگراد، 5 دقیقه در دمای 75 درجه سانتیگراد انجام شد.
انجام Real Time PCR با روش سایبرگرین
به منظور انجام Real Time PCR با روش سایبرگرین، 6 میکرولیتر cDNA، 12/5 میکرولیتر مستر میکس 2X سایبر 1میکرولیتر پرایمر فوروارد و 1 میکرولیتر پرایمر ریورس اختصاصی ژن پروتئین غشای خارجی A که در جدول شماره 2 ارائه شده است، در واکنشReal Time PCR وارد شد [36].
.jpg)
واکنش با برنامه حرارتی دستگاه ریل تایم (Roche کشور آلمان) شامل دناتوراسیون اولیه به مدت 4 دقیقه در دمای 95 درجه سانتیگراد، دناتوراسیون به مدت 10 ثانیه در دمای 94 درجه سانتیگراد، اتصال پرایمر اختصاصی به مدت 20 ثانیه در دمای 55 درجه سانتیگراد، تکثیر به مدت 25 ثانیه در دمای 72 درجه سانتیگراد برای 45 سیکل انجام شد (به دلیل احتمال خطا، این بخش از روش کار برای هر نمونه دوبار تکرار شد).
یافتهها
در بررسی مقاومت جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس تعداد کلونیهای شمارش شده هر جدایه بیشتر از CFU/ml 106 بود و ضریب بازدارندگی تمام جدایهها کمتر از 0/4 بود. این نتایج نشان داد تمامی جدایهها به اسید و نمکهای صفراوی مقاوم بوده و دارای این ویژگیهای پروبیوتیکی هستند. در مرحله بعد، بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراج شده از جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس بر روی رشد عوامل بیماریزای فرصت طلب بیمارستانی نظیر جدایه بیمارستانی اسیتوباکتربومانی 25 A با مقاومت آنتیبیوتیکی چندگانه (جداسازی شده توسط ساریخانی و همکاران از بیمارستانهای قم)، اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC و سودوموناس آئروژینوزا PAO1 نشان داد رشد این عوامل در اطراف چاهک دارای سوپرناتانت استخراج شده از باسیلوس لیکنی فورمیس بیش از سایر جدایههای مورد بررسی، در مقایسه با چاهک کنترل (اتیل استات) به طور قابل توجهی مهار شده است که نتایج آن در جدول شماره 3 ارائه شده است (تصویر شماره 1).
.jpg)
امروزه عوامل شیمی درمانی ضدمیکروبی به طور وسیعی برای کنترل عفونتهای مختلف به کار گرفته میشوند. در حال حاضر، به دلیل پیدایش سویههای مقاوم به آنتیبیوتیکها و اثرات جانبی آنها استفاده از این داروها چندان رضایتبخش نیست. همواره محققین به دنبال یافتن راهکارهای جدید برای حل این مشکل هستند که در این راستا پروبیوتیکها از اقبال خوبی برخوردار بودهاند [1 ,2]. باکتریهای پروبیوتیک از جمله باسیلوسها با تولید انواع ترکیبات مهارکننده علیه گونههای باکتریایی گرم مثبت و گرم منفی خواص ضدمیکروبی خود را اعمال میکنند و به عنوان یک روش درمانی در برخی از بیماریها مورد استفاده قرار گرفته وکاربردهای وسیعتری نیز برای آنها در آینده قابل پیشبینی است. گلناری و همکاران در یک مطالعه خاصیت ضدمیکروبی سویههای باسیلوس را بر علیه پاتوژنهای مقاوم به آنتیبیوتیک مورد بررسی قرار دادند و شاهد مهار رشد پاتوژنها با استفاده از سوپرناتانت باسیلوسها بودند [3 ,4 ,5]. عفونت بیمارستانی یکی از دلایل اصلی مرگ و میر و افزایش دوره نقاهت در بیماران است که اغلب توسط عوامل مقاوم به آنتیبیوتیک ایجاد میشود. اسینتوباکتربومانی یک باسیل گرم منفی، هوازی مطلق، غیر تخمیری و بیماریزای فرصتطلب است که قادر به ایجاد انواع عفونتهای بیمارستانی از جمله پنومونی، باکتریمی، عفونت مجاری ادراری و مننژیت در بخشهای مختلف بیمارستان بهویژه بخش مراقبت ویژه است [6, 7, 8]. این باکتری به علت دارا بودن انواعی از عوامل مؤثر در مقاومت آنتیبیوتیکی در باکتریها مانند پمپهای افلاکس، آنزیمهای بتالاکتامازی و توانایی تشکیل بیوفیلم قوی، مقاومتهای بالای آنتیبیوتیکی از خود نشان میدهند و مشکلات متعددی را در بیماران ایجاد میکند [9, 10]. توانایی تشکیل بیوفیلم در اسینتوباکتر بومانی بهعنوان یکی از فاکتورهای اصلی ویرولانس درنظر گرفته میشود که علاوه بر توانایی رشد در انواعی از محیطهای بالینی و شرایط محیطی نامناسب، سبب افزایش مقاومت باکتری به عوامل ضد میکروبی و ایجاد عفونت در بیماران میشود [11, 12] .در باکتریهای گرم منفی، یکی از فاکتورهای مؤثر در تشکیل بیوفیلم، پروتئین غشای خارجی به نام پروتئین غشای خارجی A است که در سازگاری و ویرولانس این باکتریها نقش مهمی دارد [14 ،13]. پروتئین غشای خارجی A در اتصال اسینتوباکتر بومانی به سطوح زنده و غیر زنده برای تشکیل بیوفیلم نقش دارد و باعث پایداری بیوفیلم و ایجاد مقاومت آنتیبیوتیکی میشود [15, 16]. باباپور و همکاران با بررسی ارتباط بین مقاومت آنتیبیوتیکی و حضور ژن پروتئین غشای خارجی A در اسینتو باکتر بومانی به این نتیجه رسیدند که تمامی سویههای اسینتوباکتربومانی جدا شده از نمونههای بالینی که دارای مقاومتهای چندگانه آنتیبیوتیکی بودند دارای ژن پروتئین غشای خارجی A هستند [17] نای و همکاران در یک پژوهش عنوان کردند پروتئین غشای خارجی A دارای فعالیتهای بیولوژیکی متنوع مانند اتصال به سلولهای اپی تلیال میزبان، القای مرگ سلول و دخالت در خارج کردن ترکیبات از فضای پری پلاسمی است [18, 19]. بنابراین به دلیل افزایش مقاومتهای آنتیبیوتیکی در اسینتوباکتربومانی مهار تشکیل بیوفیلم از طریق مهار بیان ژنهای مؤثر در تشکیل بیوفیلم و متعاقباً افزایش حساسیت به آنتیبیوتیکها میتواند از اهمیت ویژهای برخوردار باشد. این پژوهش با هدف شناسایی بهترین پروبیوتیک با توانایی مهار رشد و تشکیل بیوفیلم در جدایه اسینتوباکتربومانی با مقاومت آنتیبیوتیکی چندگانه از طریق مهار بیان ژن پروتئین غشای خارجی A مرتبط با تشکیل بیوفیلم در این جدایه انجام شد.
مواد و روشها
بررسی مقاومت جدایهها به اسید و نمکهای صفراوی
مطالعه حاضر بهصورت آزمایشگاهی انجام شد. جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس از دکتر پروانه جعفری در آزمایشگاه تحقیقاتی میکروبیولوژی دانشگاه آزاد اسلامی واحد اراک تهیه شد. برای بررسی مقاومت به محیط اسیدی در جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی [20, 21, 22]، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس [23, 24] و با توجه به شرایط رشد متفاوت این جدایهها، در ابتدا از هر جدایه سوسپانسیون میکروبی با غلظت حدود CFU/ml 109 تهیه شد. سپس 1 میلیلیتر از سوسپانسیون میکروبی به بافر فسفات سالین با حجم 9 میلیلیتر و pH برابر با 2 اضافه شد. برای تنظیم pH از HCL با غلظت 0/1 نرمال استفاده شد. به منظور شمارش تعداد باکتری موجود در سوسپانسیون میکروبی (یک واحد تشکیل کلنی) در زمان صفر، رقت سازی و کشت هر یک از رقتها انجام و گرماگذاری شد (کنترل). در ادامه لولههای حاوی بافر فسفات سالین در دمای 37 درجه سانتیگراد به مدت 3 ساعت گرماگذاری و سپس به محیط کشت انتقال داده و با توجه به شرایط رشد هر جدایه گرماگذاری و کلونیها شمارش شد.
برای بررسی مقاومت جدایهها به نمکهای صفراوی از روش گیلیلند و والکر استفاده شد. درنهایت با استفاده از فرمول ضریب مهار که توسط گوپال و همکاران ارائه شده است، بازدارندگی رشد جدایهها به وسیله نمکهای صفراوی اندازهگیری شد [25, 26].
استخراج سوپرناتانت
جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس با توجه به شرایط رشد اختصاصی خود کشت داده شده و سوپرناتانت آن استخراج شد [27, 28, 29]. سپس به منظور جداسازی پپتیدها با خاصیت ضدمیکروبی هر یک از سوپرناتانتهای استخراج شده، بهطور مجزا درون دکانتور با اتیل استات به نسبت 1:1 ترکیب و فاز رویی که حاوی اتیل استات و پپتیدها با خاصیت ضدمیکروبی احتمالی بود، جداسازی شد. سپس اتیل استات با استفاده از روتاری خشک شد [30].
بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراجشده علیه شاخصهای بیماریزای بیمارستانی
برای بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراج شده از روش آگار ول دیفیوژن استفاده شد. در این روش از میکروارگانسیمهایی نظیر جدایه بیمارستانی اسینتوباکتربومانی 52 A با مقاومت آنتیبیوتیکی چندگانه (جداسازی شده توسط ساریخانی و همکاران از بیمارستانهای قم [31]، اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC و سودوموناس آئروژینوزا PAO1 بهعنوان شاخصهای بیماریزای فرصتطلب بیمارستانی استفاده شد. برای این منظور ابتدا از هر یک از میکروارگانسیمهای مذکور، سوسپانسیون نیم مک فارلند تهیه شد. حجم 60 میکرولیتر از آن بر روی سطح مولر هینتون آگار (مرک، آلمان) انتقال و بهصورت سفرهای کشت داده شد. سپس با استفاده از پیپت پاستور دو چاهک ایجاد شد، ته هر یک از چاهکها با استفاده از سافت آگار پوشیده شد و به یکی از چاهکها 50 میکرو لیتر اتیل استات بهعنوان کنترل و به چاهک دیگر 50 میکرولیتر سوپرناتانت جدایه اضافه و روی چاهکها نیز با سافت آگار پوشیده شد و به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. در مرحله بعد هالههای عدم رشد میکروارگانیسمها در محیط مولر هینتون آگار در صورت مشاهده اندازهگیری شد. این بخش از روش کار به دلیل احتمال خطا برای هر جدایه 3 بار تکرار شد [32].
تعیین حداقل غلظت مهار رشد
از روش میکرودایلوشن برای تعیین حداقل غلظت مهار رشد استفاده شد. در این روش از باکتریهای اسینتوباکتربومانی 19606ATCC به عنوان کنترل و جدایه اسینتوباکتربومانی 52 A استفاده گردید. 50 میکرولیتر محیط مولر هینتون براث به تمام چاهکهای میکروپلیت اضافه شد. سپس در چاهک اول 50 میکرولیتر سوپرناتانت جدایه باسیلوس لیکنی فورمیس با غلظت 2048 میکروگرم بر میلیلیتر (وزن خشک سوپرناتانت) اضافه شد. سپس 50 میکرولیتر از چاهک اول برداشته به چاهک دوم و به همین ترتیب تا چاهک 10 که 50 میکرولیتر دور ریخته شد. 50 میکرولیتر سوپرناتانت به چاهک 12 اضافه و چاهک 11 کنترل مثبت و چاهک 12 کنترل منفی در گرفته شد. با استفاده از باکتریهای مذکور، سوسپانسیون نیم مک فارلند تهیه و به چاهکهای 1تا 11 مقدار 50 میکرولیتر از سوسپانسیون میکروبی اضافه شد. غلظت چاهکهابه ترتیب 1024-512-256-128-64-32-16-8-4-2 میکروگرم بر میلیلیتر بود. سپس میکروپلیت به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. چاهک قبل از حداقل غلظت مهار رشد محسوب میشود [33].
بررسی فنوتیپی مهار بیوفیلم در اسینتوباکتربومانی
در مرحله بعد برای بررسی فنوتیپی مهار بیوفیلم با استفاده از باکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A سوسپانسیون نیم مک فارلند تهیه و به درون هر چاهک از میکروپلیت 96 خانه 100 میکرولیتر سوسپانسیون میکروبی اضافه و بر اساس غلظت ساب حداقل غلظت مهار رشد به دست آمده به درون هر چاهک سوپرناتانت جدایه باسیلوس لیکنی فورمیس اضافه شد و به مدت 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد. در مرحله بعد به هر چاهک کریستال ویوله 1 درصد اضافه شد و بعد از 20 دقیقه چاهکها با الکل اتانول شستشو داده شد. سپس جذب چاهکها با استفاده از دستگاه الایزا ریدر مورد بررسی قرار گرفت. درنهایت، میزان مهار بیوفیلم طبق فرمول شماره 1 محاسبه شد [34]. با استفاده از میکروسکوپ الکترونی رویشی نشر میدانی توانایی تشکیل بیوفیلم در جدایه اسینتوباکتر بومانی 52 A و مهار تشکیل بیوفیلم در این جدایه بعد از تیمار با حداقل غلظت مهار کنندگی سوپرناتانت باسیلوس لیکنی فورمیس مورد بررسی قرار گرفت [35].

شناسایی ژن پروتئین غشای خارجی A مؤثر در تشکیل بیوفیلم در اسینتوباکتربومانی
استخراج ژنوم
برای شناسایی پروتئین غشای خارجی A در ابتدا ژنوم جدایه اسینتوباکتربومانی 52 A با استفاده از روش جوشاندن استخراج شد [31].
پرایمر مورداستفاده در واکنش زنجیرهای پلیمراز
پرایمر اختصاصی مورداستفاده برای شناسایی ژن پروتئین غشای خارجی A در جدول شماره 1 ارائه شده است.
.jpg)
ترکیب مواد و برنامه حرارتی مورداستفاده در واکنش زنجیرهای پلیمراز
واکنش زنجیرهای پلیمراز با حجم نهایی 25 میکرولیتر حاوی 5/13 میکرولیتر مستر میکس 2X، 1 میکرولیتر پرایمر فوروارد، 1 میکرولیتر پرایمر ریورس، 100 نانوگرم ژنوم اسینتوباکتربومانی و 4/5 میکرولیتر آب مقطر استریل انجام شد. سپس با استفاده از دستگاه ترموسایکلر برنامه دمایی شامل دناتوراسیون اولیه 4 دقیقه در دمای 94 درجه سانتیگراد، دناتوراسیون 1 دقیقه در دمای 94 درجه سانتیگراد، اتصال پرایمر اختصاصی ژن پروتئین غشای خارجی A به مدت 1 دقیقه در دمای 53 درجه سانتیگراد، تکثیر به مدت 1 دقیقه در دمای 72 درجه سانتیگراد برای 35 سیکل و تکثیر نهایی به مدت 7 دقیقه در دمای 72 درجه سانتیگراد انجام شد. در ادامه محصول حاصل از واکنش زنجیرهای پلیمراز پس از رنگآمیزی با اتیدیوم بروماید، بر روی آگارز 1درصد الکتروفورز شد (چاهک 4 کنترل منفی) و با استفاده از دستگاه ژل داکمورد بررسی قرار گرفت [31]. درنهایت، محصول حاصل از واکنش زنجیرهای پلیمراز ژن پروتئین غشای خارجی A در جدایه اسینتوباکتربومانی 52 A برای تعیین توالی به شرکت پیشگام ارسال شد.
بررسی بیان ژن موثر در تشکیل بیوفیلم (ژن پروتئین غشای خارجی A) در اسینتوباکتربومانی
برای بررسی بیان ژن در ابتدا حضور ژن پروتئین غشای خارجی A در جدایه اسینتوباکتربومانی 52 A با استفاده از تکنیک واکنش زنجیرهای پلیمراز مورد تأیید قرار گرفت. سپس بیان ژن پروتئین غشای خارجی A در باکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A با استفاده از تکنیک Real Time PCR مورد ارزیابی قرار گرفت. برای تیمار سوسپانسیون جدایه اسینتوباکتربومانی 52 A، این سوسپانسیون همراه با حداقل غلظت مهارکنندگی بیوفیلم از سوپرناتانت باسیلوس لیکنی فورمیس با هم ترکیب شده و 24 ساعت در دمای 37 درجه سانتیگراد گرماگذاری شد.
استخراج RNA از جدایه اسینتوباکتربومانی 52 A و سنتز cDNA
برای این منظور ازباکتریهای اسینتوباکتربومانی 19606ATCC بهعنوان کنترل و جدایه اسینتوباکتربومانی 52 A، قبل و بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس استخراج RNA با استفاده از کیت استخراج RNA مطابق دستورالعمل شرکت سازنده، انجام شد و با دستگاه نانودراپ (برای جلوگیری از خطای احتمالی پس از قرار دادن هر نمونه روی حسگر و اتمام سنجش، حسگر با کاغذ صافی تمیز شد) مورد بررسی قرار گرفت. برای سنتز cDNA از کیت (BIOFACT کشور کره جنوبی) مطابق دستورالعمل شرکت سازنده، استفاده شد. این مرحله در حضور رندوم هگزامر پرایمر، آنزیم ترانس کریپتاز معکوس و مخلوط دئوکسی نوکلئوزید تریفسفات و بر طبق برنامه دمایی 5 دقیقه در دمای 25 درجه سانتیگراد، 60 دقیقه در دمای 42 درجه سانتیگراد، 5 دقیقه در دمای 75 درجه سانتیگراد انجام شد.
انجام Real Time PCR با روش سایبرگرین
به منظور انجام Real Time PCR با روش سایبرگرین، 6 میکرولیتر cDNA، 12/5 میکرولیتر مستر میکس 2X سایبر 1میکرولیتر پرایمر فوروارد و 1 میکرولیتر پرایمر ریورس اختصاصی ژن پروتئین غشای خارجی A که در جدول شماره 2 ارائه شده است، در واکنشReal Time PCR وارد شد [36].
.jpg)
واکنش با برنامه حرارتی دستگاه ریل تایم (Roche کشور آلمان) شامل دناتوراسیون اولیه به مدت 4 دقیقه در دمای 95 درجه سانتیگراد، دناتوراسیون به مدت 10 ثانیه در دمای 94 درجه سانتیگراد، اتصال پرایمر اختصاصی به مدت 20 ثانیه در دمای 55 درجه سانتیگراد، تکثیر به مدت 25 ثانیه در دمای 72 درجه سانتیگراد برای 45 سیکل انجام شد (به دلیل احتمال خطا، این بخش از روش کار برای هر نمونه دوبار تکرار شد).
یافتهها
در بررسی مقاومت جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس تعداد کلونیهای شمارش شده هر جدایه بیشتر از CFU/ml 106 بود و ضریب بازدارندگی تمام جدایهها کمتر از 0/4 بود. این نتایج نشان داد تمامی جدایهها به اسید و نمکهای صفراوی مقاوم بوده و دارای این ویژگیهای پروبیوتیکی هستند. در مرحله بعد، بررسی خاصیت ضدمیکروبی سوپرناتانتهای استخراج شده از جدایههای لاکتوباسیلوس رامنوسوس، بیفیدوباکتریوم انیمالیس، پدیوکوکوس اسیدی لاکتیسی، باسیلوس سوبتیلیس، باسیلوس کواگولانس و باسیلوس لیکنی فورمیس بر روی رشد عوامل بیماریزای فرصت طلب بیمارستانی نظیر جدایه بیمارستانی اسیتوباکتربومانی 25 A با مقاومت آنتیبیوتیکی چندگانه (جداسازی شده توسط ساریخانی و همکاران از بیمارستانهای قم)، اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC و سودوموناس آئروژینوزا PAO1 نشان داد رشد این عوامل در اطراف چاهک دارای سوپرناتانت استخراج شده از باسیلوس لیکنی فورمیس بیش از سایر جدایههای مورد بررسی، در مقایسه با چاهک کنترل (اتیل استات) به طور قابل توجهی مهار شده است که نتایج آن در جدول شماره 3 ارائه شده است (تصویر شماره 1).
.jpg)
نتایج حاصل از حداقل غلظت مهار رشد نشان داد حداقل غلظت مهارکنندگی سوپرناتانت جدایه باسیلوس لیکنی فورمیس، غلظت 32 میکروگرم بر میلیلیتر است. همچنین نتایج بررسی مهار فنوتیپی بیوفیلم نشان داد سوپرناتانت باسیلوس لیکنی فورمیس قادر است تشکیل بیوفیلم در جدایه اسینتوباکتر بومانی52 A را به میزان 70 درصد کاهش دهد. نتایج بررسی تشکیل بیوفیلم در جدایه اسینتوباکتربومانی52 A قبل و بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس با میکروسکوپ الکترونی، تفاوت چشمگیری در مهار تشکیل بیوفیلم بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس را نشان داد (تصویر شماره 2).
در نتایج حاصل از واکنش زنجیرهای پلیمراز برای بررسی حضور ژن پروتئین غشای خارجی A در جدایه اسینتوباکتربومانی52 A یک باندbp 578 مشاهده شد (تصویر شماره 3).
توالی نوکلئوتیدی خوانده شده مربوط به محصول واکنش زنجیرهای پلیمراز در سایت مرکز ملی بیوتکنولوژی و اطلاعات تحت آنالیز بلاست قرار گرفت. نتایج حاصل از بلاست نشان داد توالی محصول واکنش زنجیرهای پلیمراز مربوط به ژن پروتئین غشای خارجی A، 99/63 درصد با توالی ژن پروتئین غشای خارجی A در سویه اسینتوباکتربومانی موجود در سایت مرکز ملی بیوتکنولوژی و اطلاعات تشابه دارد (تصویر شماره 4).
ارزیابی بیان ژن پروتئین غشای خارجی A با استفاده از تکنیک Real Time PCR در اسینتوباکتربومانی قبل و بعد از تیمار با سوپرناتانت جدایه باسیلوس لیکنی فورمیس، نشان داد بیان ژن پروتئین غشای خارجی A در سویه اسینتوباکتربومانی استاندارد 19606 (کنترل) به میزان 74/71 درصد با 0/0001>P و در جدایه اسینتوباکتر بومانی 52 A (آزمایش) به میزان 69/72 درصد با 0/0001>P کاهش معناداری داشته است (تصویر شماره 5).
بحث
امروزه پاتوژنهای فرصت طلب ESKAPE (انتروکوکوس فاسیوم، استافیلوکوکوس اورئوس، کلبسیلا پنومونیه، اسینتوباکتربومانی، سودوموناس آئروژینوزا، انتروباکتر) در محیط بیمارستان در افراد با سیستم ایمنی ضعیف با ایجاد انواع عفونتهای بیمارستانی، مشکلات متعددی را در حوزه سلامت ایجاد میکنند. در میان این پاتوژنها، اسینتوباکتربومانی به دلیل مقاومت بالای آنتیبیوتیکی از اهمیت ویژهای برخوردار است [37]. در مطالعه حاضر مهار چشمگیر رشد عوامل بیماریزای فرصتطلب بیمارستانی نظیر اسینتوباکتربومانی ،A 52اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC، سودوموناس آئروژینوزا و مهار 70 درصدی تشکیل بیوفیلم در اسینتوباکتربومانی با استفاده از سوپرناتانت باسیلوس لیکنی فورمیس مشاهده شد. در یک مطالعه مشابه که توسط کارلی و همکاران انجام شد [38]، خاصیت ضد بیوفیلمی سوپرناتانت باسیلوس لیکنی فورمیس بر روی جدایههای استافیلوکوکوس اورئوس و سودوموناس آئروژینوزا مورد بررسی قرار گرفت و مهار تشکیل بیوفیلم در این دو باکتری در حضور سوپرناتانت باسیلوس لیکنی فورمیس گزارش شد که با نتایج تحقیق حاضر همخوانی دارد. دوسان و همکاران [5] در پژوهشی تلاش کردند با استفاده از باسیلوس لیکنی فورمیس در تشکیل بیوفیلم باکتریهای بیماریزا اختلال ایجاد کنند. آنها موفق به جداسازی پروتئینی شدند که قادر به کاهش تشکیل بیوفیلم در جدایههای کاندیدا آلبیکانس و سودوموناس آئروژینوزا شد. همچنین ابوسایم و همکاران در یک مطالعه نشان دادند [39] که با استفاده از اگزوپلی ساکارید خالص سازی شده از جدایه باسیلوس لیکنی فورمیس، مهار بیوفیلم در باکتریهای بیماریزا رخ داده است. نتایج مطالعات ذکر شده، پتانسیل بالای باسیلوس لیکنی فورمیس در مهار بیوفیلم عوامل بیماریزا را نشان میدهد با نتایج حاصل از تحقیق حاضر مبنی بر مهار بالای تشکیل بیوفیلم در اسینتوباکتربومانی با استفاده از سوپرناتانت باسیلوس لیکنی فورمیس مطابقت دارد. سپس در مطالعه حاضر ژن پروتئین غشای خارجی A، در جدایه بیمارستانی اسینتوباکتربومانی 52 A با مقاومت آنتیبیوتیکی چندگانه با استفاده از روش واکنش زنجیرهای پلیمراز شناسایی شد. در یک مطالعه الشامیری و همکاران [10] با بررسی حضور ژن پروتئین غشای خارجی A در جدایههای بالینی اسینتوباکتربومانی با مقاومت آنتیبیوتیکی MDR و XDR با استفاده از روش واکنش زنجیرهای پلیمراز، مشاهده کردند این ژن در میان این جدایهها حضور دارد. اسکرنیسکیت و همکاران پاسخ سیستم ایمنی موش 774 علیه سویههای اسینتوباکتربومانی واجد و فاقد ژن پروتئین غشای خارجی A را مورد بررسی قرار دادند [40] و مشاهده کردند که سیستم ایمنی موش بر علیه سویههای فاقد این ژن، پاسخ التهابی کمتری ایجاد میکند. با توجه به مطالعات ذکر شده، اهمیت ژن پروتئین غشای خارجی A در بیماریزایی اسینتوباکتربومانی تأیید میشود. از اینرو، در مطالعه حاضر، مهار بیان این ژن با سوپرناتانت باسیلوس لیکنی فورمیس مورد بررسی قرار گرفت. بررسی بیان ژن پروتئین غشای خارجی A قبل و بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس با استفاده از تکنیک Real Time PCR نشان داد بیان ژن پروتئین غشای خارجی A در جدایه اسینتوباکتر بومانی 52 A پس از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس در مقایسه با بیان این ژن قبل از تیمار، 69/72 درصد کاهش یافته است. در یک پژوهش نا و همکاران [41] با در نظر گرفتن نقش مهم پروتئین غشای خارجی A در ایجاد مقاومت آنتیبیوتیکی در اسینتوباکتر بومانی، تلاش کردند با استفاده از ترکیبات شیمیایی بیان ژن پروتئین غشای خارجی A را مهار کنند. در نهایت از میان ترکیبات مختلف موفق به شناسایی 3 ترکیب شیمیایی شدند که با مهار بیان ژن پروتئین غشای خارجی A منجر به کاهش تشکیل بیوفیلم در این باکتری شد. در مطالعهای دیگر سلواراج و همکاران [42] با استفاده از ماده استخراج شده از گیاه به نام میرتنول، توانستند ژنهای مرتبط با تشکیل بیوفیلم از جمله pgaA ،ompA, bap ،csuA/B را مهار کنند. این دانشمندان مشاهده کردند که با سرکوب این ژنها بیوفیلم نازکتری در اسینتوباکتر بومانی ایجاد شده است. نتایج تحقیق کنونی مبنی بر کاهش بیان ژن پروتئین غشای خارجی A در اسینتوباکتر بومانی با کمک سوپرناتانت باسیلوس لیکنی فورمیس و تأثیر آن در کاهش تشکیل بیوفیلم در این باکتری که با نتایج مطالعات ذکر شده نیز همخوانی دارد، نشان دهنده این حقیقت است که با دستیابی به ترکیب یا ترکیباتی برای کاهش بیان ژنهای مؤثر در تشکیل بیوفیلم به دلیل اهمیت آن در مقاومت آنتیبیوتیکی باکتریهای بیماریزا، میتوان موفق به کنترل این عوامل شد. بنابراین در مطالعه حاضر، مشخص شد باسیلوس لیکنی فورمیس با کاهش بیان ژن پروتئین غشای خارجی A و احتمالاً کاهش بیان سایر ژنهای مؤثر در تشکیل بیوفیلم در اسینتوباکتر بومانی که نیاز به بررسی دارند، خاصیت ضدمیکروبی و ضد بیوفیلمی خود را اعمال کرده است.
نتیجهگیری
نتایج این مطالعه برای اولین بار در دنیا نشان داد باسیلوس لیکنی فورمیس توانایی مناسبی در جهت مهار بیان ژن مؤثر در تشکیل بیوفیلم در اسینتوباکتر بومانی، بهعنوان یک عامل ایجاد کننده عفونتهای بیمارستانی را دارد. با توجه به پتانسیل بالای باسیلوس لیکنی فورمیس در تولید ترکیبات با خاصیت ضدمیکروبی و ضدبیوفیلمی پیشنهاد میشود در تحقیقات آینده این ترکیبات مورد شناسایی بیشتر قرار گرفته و بهعنوان مواد زیستی کمخطر برای کاهش بیوفیلم عوامل بیماریزای دارای مقاومت آنتیبیوتیکی در محیطهای درمانی مورد استفاده قرار گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با کد اخلاق IR.IAU.QOM.REC.1398.004 به تصویب کمیته اخلاق دانشکده علومپزشکی دانشگاه آزاد اسلامی واحد قم رسید.
حامی مالی
این مقاله برگرفته از رساله دکتری تخصصی نویسنده اول در گروه میکروبیولوژی، دانشکده علومپایه، دانشگاه آزاد اسلامی واحد قم است.
مشارکت نویسندگان
تمامی اعضای نویسندگان در پژوهش و آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از پرسنل محترم آزمایشگاه تحقیقاتی میکروبیولوژی دانشگاه آزاد اسلامی واحد قم تشکر و قدردانی میشود.
امروزه پاتوژنهای فرصت طلب ESKAPE (انتروکوکوس فاسیوم، استافیلوکوکوس اورئوس، کلبسیلا پنومونیه، اسینتوباکتربومانی، سودوموناس آئروژینوزا، انتروباکتر) در محیط بیمارستان در افراد با سیستم ایمنی ضعیف با ایجاد انواع عفونتهای بیمارستانی، مشکلات متعددی را در حوزه سلامت ایجاد میکنند. در میان این پاتوژنها، اسینتوباکتربومانی به دلیل مقاومت بالای آنتیبیوتیکی از اهمیت ویژهای برخوردار است [37]. در مطالعه حاضر مهار چشمگیر رشد عوامل بیماریزای فرصتطلب بیمارستانی نظیر اسینتوباکتربومانی ،A 52اسینتوباکتربومانی 19606 ATCC، کلبسیلا پنومونیه 70063 ATCC، سودوموناس آئروژینوزا و مهار 70 درصدی تشکیل بیوفیلم در اسینتوباکتربومانی با استفاده از سوپرناتانت باسیلوس لیکنی فورمیس مشاهده شد. در یک مطالعه مشابه که توسط کارلی و همکاران انجام شد [38]، خاصیت ضد بیوفیلمی سوپرناتانت باسیلوس لیکنی فورمیس بر روی جدایههای استافیلوکوکوس اورئوس و سودوموناس آئروژینوزا مورد بررسی قرار گرفت و مهار تشکیل بیوفیلم در این دو باکتری در حضور سوپرناتانت باسیلوس لیکنی فورمیس گزارش شد که با نتایج تحقیق حاضر همخوانی دارد. دوسان و همکاران [5] در پژوهشی تلاش کردند با استفاده از باسیلوس لیکنی فورمیس در تشکیل بیوفیلم باکتریهای بیماریزا اختلال ایجاد کنند. آنها موفق به جداسازی پروتئینی شدند که قادر به کاهش تشکیل بیوفیلم در جدایههای کاندیدا آلبیکانس و سودوموناس آئروژینوزا شد. همچنین ابوسایم و همکاران در یک مطالعه نشان دادند [39] که با استفاده از اگزوپلی ساکارید خالص سازی شده از جدایه باسیلوس لیکنی فورمیس، مهار بیوفیلم در باکتریهای بیماریزا رخ داده است. نتایج مطالعات ذکر شده، پتانسیل بالای باسیلوس لیکنی فورمیس در مهار بیوفیلم عوامل بیماریزا را نشان میدهد با نتایج حاصل از تحقیق حاضر مبنی بر مهار بالای تشکیل بیوفیلم در اسینتوباکتربومانی با استفاده از سوپرناتانت باسیلوس لیکنی فورمیس مطابقت دارد. سپس در مطالعه حاضر ژن پروتئین غشای خارجی A، در جدایه بیمارستانی اسینتوباکتربومانی 52 A با مقاومت آنتیبیوتیکی چندگانه با استفاده از روش واکنش زنجیرهای پلیمراز شناسایی شد. در یک مطالعه الشامیری و همکاران [10] با بررسی حضور ژن پروتئین غشای خارجی A در جدایههای بالینی اسینتوباکتربومانی با مقاومت آنتیبیوتیکی MDR و XDR با استفاده از روش واکنش زنجیرهای پلیمراز، مشاهده کردند این ژن در میان این جدایهها حضور دارد. اسکرنیسکیت و همکاران پاسخ سیستم ایمنی موش 774 علیه سویههای اسینتوباکتربومانی واجد و فاقد ژن پروتئین غشای خارجی A را مورد بررسی قرار دادند [40] و مشاهده کردند که سیستم ایمنی موش بر علیه سویههای فاقد این ژن، پاسخ التهابی کمتری ایجاد میکند. با توجه به مطالعات ذکر شده، اهمیت ژن پروتئین غشای خارجی A در بیماریزایی اسینتوباکتربومانی تأیید میشود. از اینرو، در مطالعه حاضر، مهار بیان این ژن با سوپرناتانت باسیلوس لیکنی فورمیس مورد بررسی قرار گرفت. بررسی بیان ژن پروتئین غشای خارجی A قبل و بعد از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس با استفاده از تکنیک Real Time PCR نشان داد بیان ژن پروتئین غشای خارجی A در جدایه اسینتوباکتر بومانی 52 A پس از تیمار با سوپرناتانت باسیلوس لیکنی فورمیس در مقایسه با بیان این ژن قبل از تیمار، 69/72 درصد کاهش یافته است. در یک پژوهش نا و همکاران [41] با در نظر گرفتن نقش مهم پروتئین غشای خارجی A در ایجاد مقاومت آنتیبیوتیکی در اسینتوباکتر بومانی، تلاش کردند با استفاده از ترکیبات شیمیایی بیان ژن پروتئین غشای خارجی A را مهار کنند. در نهایت از میان ترکیبات مختلف موفق به شناسایی 3 ترکیب شیمیایی شدند که با مهار بیان ژن پروتئین غشای خارجی A منجر به کاهش تشکیل بیوفیلم در این باکتری شد. در مطالعهای دیگر سلواراج و همکاران [42] با استفاده از ماده استخراج شده از گیاه به نام میرتنول، توانستند ژنهای مرتبط با تشکیل بیوفیلم از جمله pgaA ،ompA, bap ،csuA/B را مهار کنند. این دانشمندان مشاهده کردند که با سرکوب این ژنها بیوفیلم نازکتری در اسینتوباکتر بومانی ایجاد شده است. نتایج تحقیق کنونی مبنی بر کاهش بیان ژن پروتئین غشای خارجی A در اسینتوباکتر بومانی با کمک سوپرناتانت باسیلوس لیکنی فورمیس و تأثیر آن در کاهش تشکیل بیوفیلم در این باکتری که با نتایج مطالعات ذکر شده نیز همخوانی دارد، نشان دهنده این حقیقت است که با دستیابی به ترکیب یا ترکیباتی برای کاهش بیان ژنهای مؤثر در تشکیل بیوفیلم به دلیل اهمیت آن در مقاومت آنتیبیوتیکی باکتریهای بیماریزا، میتوان موفق به کنترل این عوامل شد. بنابراین در مطالعه حاضر، مشخص شد باسیلوس لیکنی فورمیس با کاهش بیان ژن پروتئین غشای خارجی A و احتمالاً کاهش بیان سایر ژنهای مؤثر در تشکیل بیوفیلم در اسینتوباکتر بومانی که نیاز به بررسی دارند، خاصیت ضدمیکروبی و ضد بیوفیلمی خود را اعمال کرده است.
نتیجهگیری
نتایج این مطالعه برای اولین بار در دنیا نشان داد باسیلوس لیکنی فورمیس توانایی مناسبی در جهت مهار بیان ژن مؤثر در تشکیل بیوفیلم در اسینتوباکتر بومانی، بهعنوان یک عامل ایجاد کننده عفونتهای بیمارستانی را دارد. با توجه به پتانسیل بالای باسیلوس لیکنی فورمیس در تولید ترکیبات با خاصیت ضدمیکروبی و ضدبیوفیلمی پیشنهاد میشود در تحقیقات آینده این ترکیبات مورد شناسایی بیشتر قرار گرفته و بهعنوان مواد زیستی کمخطر برای کاهش بیوفیلم عوامل بیماریزای دارای مقاومت آنتیبیوتیکی در محیطهای درمانی مورد استفاده قرار گیرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با کد اخلاق IR.IAU.QOM.REC.1398.004 به تصویب کمیته اخلاق دانشکده علومپزشکی دانشگاه آزاد اسلامی واحد قم رسید.
حامی مالی
این مقاله برگرفته از رساله دکتری تخصصی نویسنده اول در گروه میکروبیولوژی، دانشکده علومپایه، دانشگاه آزاد اسلامی واحد قم است.
مشارکت نویسندگان
تمامی اعضای نویسندگان در پژوهش و آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از پرسنل محترم آزمایشگاه تحقیقاتی میکروبیولوژی دانشگاه آزاد اسلامی واحد قم تشکر و قدردانی میشود.
References
1.Kyriakidis I, Vasileiou E, Dorothea Pana Z, Tragiannidis A. Acinetobacter baumannii antibiotic resistance mechanisms. Pathogens. 2021; 10(3):373. [DOI:10.3390/pathogens10030373] [PMID] [PMCID]
2.Girijaa V, Malaikozhundana B, Vaseeharana B, Vijayakumara S, Gobia N, Del Valle Herrerab M, et al. In vitro antagonistic activity and the protective effect of probiotic Bacillus licheniformis dahb1 in zebra fish challenged with gfp tagged Vibrio parahaemolyticus dahv2. Microb Pathog. 2018; 114:274-80. [DOI:10.1016/j.micpath.2017.11.058] [PMID]
3.Golnari Maranni M, Rabbani Khourasgani M, Asadollahi MA, Shafiei R. [Evaluation of antimicrobial activity of bacillus strains isolated from various resources (Persian)]. J Arak Med Univ J. 2017; 19(116):68-78. http://jams.arakmu.ac.ir/article-1-4673-fa.pdf
4.Shahrestan F, Jafari P, Gharebaghi A, Khani Farahani I, Shahrestan E. [Effect of biofiora and cinnamon extract consumption on dyslipidemia and cardiovascular disease in a diabetic rat model (Persian)]. J Arak Univ Med Sci. 2020; 23(2):198-208. [DOI:10.32598/JAMS.23.2.5997.1]
5.Dusane DH, Damare SR, Nancharaiah YV, Ramaiah N, Venugopalan VP, Kumar AR, et al. Disruption of microbial biofilms by an extracellular protein isolated from epibiotic tropical marine strain of Bacillus licheniformis. Plos One. 2013; 8(5):e64501. [DOI:10.1371/journal.pone.0064501] [PMID] [PMCID]
6.Pompilio A, Scribano D, Sarshar M, Bonaventura GD, Palamara AT, Ambrosi C. Gram-negative bacteria holding together in a biofilm: The Acinetobacter baumannii way. Microorganisms. 2021; 9(7):1353. [DOI:10.3390/microorganisms9071353] [PMID] [PMCID]
7.Rouhi V, Safarkar R, Habibi S. Phonotypic investigation of biofilm formation and determination of presence of bap and blaOXA-51 genes in acinetobacter baumannii from clinical specimens in Tehran. Iran J Med Microbiol. 2020; 14(6):566-83. https://ijmm.ir/article-1-1110-fa.pdf [DOI:10.30699/ijmm.14.6.566]
8.Saleh Nia A, Nojoomi F. [Phenotypic study of extended-spectrum beta lactamase (esbl) producing isolates of acinetobacter baumannii in patients reffered to a military hospital in guilan province (Persian)]. Iran J Biol. 2019; 32(4):454-8. https://cell.ijbio.ir/article_1301.html
9.Mea HJ, Yong PV, Wong EH. An overview of Acinetobacter baumannii pathogenesis: Motility, adherence and biofilm formation. Microbiol Res. 2021; 247:126722. [DOI:10.1016/j.micres.2021.126722] [PMID]
10.Al-Shamiri MM, Zhang S, Mi P, Liu Y, Xun M, Yang E, et al. Phenotypic and genotypic characteristics of Acinetobacter baumannii enrolled in the relationship among antibiotic resistance, biofilm formation and motility. Microb Pathog. 2021; 155:104922. [DOI:10.1016/j.micpath.2021.104922] [PMID]
11.Luo L, Wu L, Xiao Y, Zhao D, Chen Z, Kang M, et al. Enhancing pili assembly and biofilm formation in Acinetobacter baumannii ATCC 19606 using non-native acyl-homoserin lactones. BMC Microbiol. 2015; 15:62. [DOI:10.1186/s12866-015-0397-5] [PMID] [PMCID]
12.Colquhoun J, Rather P. Insights into mechanisms of biofilm formation in Acinetobacter baumannii and implications for uropathogenesis. Front Cell Infect Microbiol. 2020; 10:253. [DOI:10.3389/fcimb.2020.00253] [PMID] [PMCID]
13.Li Z, Ding Z, Liu Y, Jin X, Xie J, Li T, et al. Phenotypic and genotypic characteristics of biofilm formation in clinical isolates of Acinetobacter baumannii. Infect Drug Resist. 2021; 14:2613-24. [DOI:10.2147/IDR.S310081] [PMID] [PMCID]
14.Azizi O, Shahcheraghi F, Salimizand H, Modarresi F, Shakibaie M, Mansouri SH, et al. Molecular analysis and expression of bap gene in biofilm-forming multi-drug-resistant Acinetobacter baumannii. Rep Biochem Mol Biol. 2016; 5(1):62-72. [PMCID]
15.Mozafari H, Mirkalantari SH, Sadeghi Kalani B, Amirmozafari N. Prevalence determination of virulence related and biofilm formation genes in Acinetobacter baumannii isolates from clinical respiratory samples in Imam khomeini hospital,Tehran,Iran 2018. Iran J Med Microbiol. 2021; 15(3):266-80. [DOI:10.30699/ijmm.15.3.266]
16.Uooalapati SR, Sett A, Pathania R. The outer membrane proteins ompA, carO, and oprD of Acinetobacter baumannii confer a two-pronged defense in facilitating its success as potent human pathogen. Front Microbiol. 2020; 11:589234. [DOI:10.3389/fmicb.2020.589234] [PMID] [PMCID]
17.Babapour E, Haddadi A, Mirnejad R, Angaji SA, Amirmozafari N. Study of drug resistance and ompa gene existence in clinical Acinetobacter baumannii isolates. Iran J Med Microbiol. 2017; 11(1):30-8. https://ijmm.ir/article-1-568-en.html
18.Lee HW, Koh YM, Kim J, Lee JC, Lee YC, Seol SY, et al. Capacity of multidrug resistant clinical isolates of Acinetobacter baumannii to form biofilm and adhere to epithelial cell surfaces. Clin Microbiol Infect. 2008; 14(1):49-54. [DOI:10.1111/j.1469-0691.2007.01842.x] [PMID]
19.Nie D, Hu Y, Chen Z, Li Z, Hou Z, Luo X, et al. Outer membrane protein a(OmpA)as a potential therapeutic target for Acinetobacter baumannii infection. J Biomed Sci. 2020; 27(1):26. [DOI:10.1186/s12929-020-0617-7] [PMID] [PMCID]
20.Jang HJ, Son S, Kim JA, Jung MY, Choi YJ, Kim DH, et al. Characterization and functional test of canine probiotics. Front Microbiol. 2021; 12:625562. [DOI:10.3389/fmicb.2021.625562] [PMID] [PMCID]
21.Awasti N, Tomar SK, Pophaly SD, Poonam, Lule VK, Singh TP, et al. Probiotic and functional characterization of bifidobacteria of Indian human origin. J Appl Microbiol. 2016; 120(4):1021-32. [DOI:10.1111/jam.13086] [PMID]
22.Diguta CF, Nitoi GD, Matei F, Luta G, Cornea CP. The biotechnological potential of pediococcus spp.isolated from kombucha microbial consortium. Foods. 2020; 9(12):1780. [DOI:10.3390/foods9121780] [PMID] [PMCID]
23.Belviso S, Giordano M, Dolci P, Zeppa G. In vitro cholesterol-lowering activity of Lactobacillus plantarum and Lactobacillus paracasei strains isolated from the Italian castelmagno pdo cheese. Dairy Sci Technol. 2009; 89(2):169-76. [DOI:10.1051/dst/2009004]
24.Bacha K, Mehari T, Ashenafi M. In-vitro probiotic potential of lactic acid bacteria isolated from wakalim, a traditional ethiopian fermented beef sausage. Ethiop J Health Sci. 2009; 19(1):21-7. https://www.ajol.info/index.php/ejhs/article/view/145938
25.Gilliland SE, Walker DK. Factors to consider when selecting a culture of Lactobacillus acidophilus as a dietary adjunct to produce a hypocholesterolemic effect in humans. J Dairy Sci. 1990; 73(4):905-11. [DOI:10.3168/jds.S0022-0302(90)78747-4]
26.Gopal PK, Prasad J Smart J, Gill HS. In vitro adherence properties of Lactobacillus rhamnosus dr20 and Bifidobacterium lactis dr10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli. Int J Food Microbiol. 2001; 67(3):207-16. [DOI:10.1016/S0168-1605(01)00440-8]
27.Fuochi V, Coniglio MA, Laghi L, Rescifina A, Caruso M, Stivala A, et al. Metabolic characterization of supernatants produced by Lactobacillus spp. With In vitro Anti-legionella activity. Front Microbiol. 2019; 10:1403. [DOI:10.3389/fmicb.2019.01403] [PMID] [PMCID]
28.Saberian M, Shahidi Delshad E, Hbibi M. The effect of Bifidobacterium bifidum supernatant and cell mass on the proliferation potential of rat bone marrow-derived stromal cells. Iran J Med Sci. 2020; 45(4):269-76. [PMCID]
29.Sharma G, Dang S, Gupta S, Gabrani R. Identification and molecular characterization of bacteria having antimicrobial and antibiofilm activity. Int J Pharm Pharm Sci. 2016; 8(10):111-4. [DOI:10.22159/ijpps.2016v8i10.12338]
30.Dimkic I, Stankovic S, Nisavic M, Petkovic M, Ristivojevic P, Fira D, et al. The profile and antimicrobial activity of Bacillus lipopeptide extracts of five potential biocontrol strains. Front Microbiol. 2017; 8:925. [DOI:10.3389/fmicb.2017.00925] [PMCID]
31.Sarikhani Z, Nazari R, Nateghi Rostami M. First report of oxa-143-lactamase producing Acinetobacter baumannii in Qom, Iran. Iran J Basic Med Sci. 2017; 20(11):1282-86. [PMCID]
32.Balouiri M, Sadiki M, Ibnsouda SK. Method for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 2016; 6(2):71-9. [DOI:10.1016/j.jpha.2015.11.005] [PMID] [PMCID]
33.Sacco F, Visca P, Runci F, Antonelli G, Raponi G. Susceptibility testing of colistin for Acinetobacter baumannii: How far are we from the truth. Antibiotics. 2021; 10(1):48. [DOI:10.3390/antibiotics10010048] [PMID] [PMCID]
34.Hetta HF, Al-kadmy IMS, Khazaal SS, Abbas S, Suhail A, El-mokhtar MA, et al. Antibiofilm and antivirulence potential of silver nanoparticles against multidrug-resistant Acinetobacter baumannii. Sci Rep. 2021; 11(1):10751. [DOI:10.1038/s41598-021-90208-4] [PMID] [PMCID]
35.Jayathilaka EHTT, Rajapaksha DC, Nikapitiya C, De zoysa M, Whang I. Antimicrobial and anti-biofilm peptide octominin for controlling multidrug-resistant Acinetobacter baumannii. Int J Mol Sci. 2021; 22(10):5353. [DOI:10.3390/ijms22105353] [PMID] [PMCID]
36.Longo F, Vuotto C, Donelli F. Biofilm formation in Acinetobacter baumannii. New Microbiol. 2014; 37(2):119-27. [PMID]
37.Monem S, Furmanek Blaszk B, Lupkowska A, Kuczynska Wisnik D, Stojowska Swedrzynska K, Laskowska E. Mechanisms protecting Acinetobacter baumannii against multiple stresses triggered by the host immune response, antibiotics and outside-host environment. Int J Mol Sci. 2020; 21(15):5498. [DOI:10.3390/ijms21155498] [PMID] [PMCID]
38.Karley D, Shukla SK, Toleti SR. Anti-biofilm activity of Bacillus licheniformis culture supernatant against Staphlococcus aureus and Pseudomonas aeruginosa. In International Conference on Recent Trends in Biosciences (ICRTB 2016), 2016 April 7-10. India. https://www.researchgate.net/publication/311675394
39.Abu sayem SM, Manzo E, Ciavatta L, Tramice A, Cordone A, Zanfardino A , et al. Anti-biofilm activity of an exopolysaccharide from a sponge-associated strain of Bacillus licheniformis. Microb Cell Fact. 2011; 10:74. [DOI:10.1186/1475-2859-10-74] [PMID] [PMCID]
40.Skerniskyt J, Karazijait E, Luciunait A, Suziedelien E. OmpA protein-deficient Acinetobacter baumannii outer membrane vesicles trigger reduced inflammatory response. Pathogens. 2021; 10(4):407. [DOI:10.3390/pathogens10040407] [PMID] [PMCID]
41.Na SH, Jeon H, Oh MH, Kim YJ, Lee JC. Screening of small molecules attenuating biofilm formation of acinetobacter baumannii by inhibition of ompA promoter activity. J Microbiol. 2021; 59(9):871-78. [DOI:10.1007/s12275-021-1394-z] [PMID]
2.Girijaa V, Malaikozhundana B, Vaseeharana B, Vijayakumara S, Gobia N, Del Valle Herrerab M, et al. In vitro antagonistic activity and the protective effect of probiotic Bacillus licheniformis dahb1 in zebra fish challenged with gfp tagged Vibrio parahaemolyticus dahv2. Microb Pathog. 2018; 114:274-80. [DOI:10.1016/j.micpath.2017.11.058] [PMID]
3.Golnari Maranni M, Rabbani Khourasgani M, Asadollahi MA, Shafiei R. [Evaluation of antimicrobial activity of bacillus strains isolated from various resources (Persian)]. J Arak Med Univ J. 2017; 19(116):68-78. http://jams.arakmu.ac.ir/article-1-4673-fa.pdf
4.Shahrestan F, Jafari P, Gharebaghi A, Khani Farahani I, Shahrestan E. [Effect of biofiora and cinnamon extract consumption on dyslipidemia and cardiovascular disease in a diabetic rat model (Persian)]. J Arak Univ Med Sci. 2020; 23(2):198-208. [DOI:10.32598/JAMS.23.2.5997.1]
5.Dusane DH, Damare SR, Nancharaiah YV, Ramaiah N, Venugopalan VP, Kumar AR, et al. Disruption of microbial biofilms by an extracellular protein isolated from epibiotic tropical marine strain of Bacillus licheniformis. Plos One. 2013; 8(5):e64501. [DOI:10.1371/journal.pone.0064501] [PMID] [PMCID]
6.Pompilio A, Scribano D, Sarshar M, Bonaventura GD, Palamara AT, Ambrosi C. Gram-negative bacteria holding together in a biofilm: The Acinetobacter baumannii way. Microorganisms. 2021; 9(7):1353. [DOI:10.3390/microorganisms9071353] [PMID] [PMCID]
7.Rouhi V, Safarkar R, Habibi S. Phonotypic investigation of biofilm formation and determination of presence of bap and blaOXA-51 genes in acinetobacter baumannii from clinical specimens in Tehran. Iran J Med Microbiol. 2020; 14(6):566-83. https://ijmm.ir/article-1-1110-fa.pdf [DOI:10.30699/ijmm.14.6.566]
8.Saleh Nia A, Nojoomi F. [Phenotypic study of extended-spectrum beta lactamase (esbl) producing isolates of acinetobacter baumannii in patients reffered to a military hospital in guilan province (Persian)]. Iran J Biol. 2019; 32(4):454-8. https://cell.ijbio.ir/article_1301.html
9.Mea HJ, Yong PV, Wong EH. An overview of Acinetobacter baumannii pathogenesis: Motility, adherence and biofilm formation. Microbiol Res. 2021; 247:126722. [DOI:10.1016/j.micres.2021.126722] [PMID]
10.Al-Shamiri MM, Zhang S, Mi P, Liu Y, Xun M, Yang E, et al. Phenotypic and genotypic characteristics of Acinetobacter baumannii enrolled in the relationship among antibiotic resistance, biofilm formation and motility. Microb Pathog. 2021; 155:104922. [DOI:10.1016/j.micpath.2021.104922] [PMID]
11.Luo L, Wu L, Xiao Y, Zhao D, Chen Z, Kang M, et al. Enhancing pili assembly and biofilm formation in Acinetobacter baumannii ATCC 19606 using non-native acyl-homoserin lactones. BMC Microbiol. 2015; 15:62. [DOI:10.1186/s12866-015-0397-5] [PMID] [PMCID]
12.Colquhoun J, Rather P. Insights into mechanisms of biofilm formation in Acinetobacter baumannii and implications for uropathogenesis. Front Cell Infect Microbiol. 2020; 10:253. [DOI:10.3389/fcimb.2020.00253] [PMID] [PMCID]
13.Li Z, Ding Z, Liu Y, Jin X, Xie J, Li T, et al. Phenotypic and genotypic characteristics of biofilm formation in clinical isolates of Acinetobacter baumannii. Infect Drug Resist. 2021; 14:2613-24. [DOI:10.2147/IDR.S310081] [PMID] [PMCID]
14.Azizi O, Shahcheraghi F, Salimizand H, Modarresi F, Shakibaie M, Mansouri SH, et al. Molecular analysis and expression of bap gene in biofilm-forming multi-drug-resistant Acinetobacter baumannii. Rep Biochem Mol Biol. 2016; 5(1):62-72. [PMCID]
15.Mozafari H, Mirkalantari SH, Sadeghi Kalani B, Amirmozafari N. Prevalence determination of virulence related and biofilm formation genes in Acinetobacter baumannii isolates from clinical respiratory samples in Imam khomeini hospital,Tehran,Iran 2018. Iran J Med Microbiol. 2021; 15(3):266-80. [DOI:10.30699/ijmm.15.3.266]
16.Uooalapati SR, Sett A, Pathania R. The outer membrane proteins ompA, carO, and oprD of Acinetobacter baumannii confer a two-pronged defense in facilitating its success as potent human pathogen. Front Microbiol. 2020; 11:589234. [DOI:10.3389/fmicb.2020.589234] [PMID] [PMCID]
17.Babapour E, Haddadi A, Mirnejad R, Angaji SA, Amirmozafari N. Study of drug resistance and ompa gene existence in clinical Acinetobacter baumannii isolates. Iran J Med Microbiol. 2017; 11(1):30-8. https://ijmm.ir/article-1-568-en.html
18.Lee HW, Koh YM, Kim J, Lee JC, Lee YC, Seol SY, et al. Capacity of multidrug resistant clinical isolates of Acinetobacter baumannii to form biofilm and adhere to epithelial cell surfaces. Clin Microbiol Infect. 2008; 14(1):49-54. [DOI:10.1111/j.1469-0691.2007.01842.x] [PMID]
19.Nie D, Hu Y, Chen Z, Li Z, Hou Z, Luo X, et al. Outer membrane protein a(OmpA)as a potential therapeutic target for Acinetobacter baumannii infection. J Biomed Sci. 2020; 27(1):26. [DOI:10.1186/s12929-020-0617-7] [PMID] [PMCID]
20.Jang HJ, Son S, Kim JA, Jung MY, Choi YJ, Kim DH, et al. Characterization and functional test of canine probiotics. Front Microbiol. 2021; 12:625562. [DOI:10.3389/fmicb.2021.625562] [PMID] [PMCID]
21.Awasti N, Tomar SK, Pophaly SD, Poonam, Lule VK, Singh TP, et al. Probiotic and functional characterization of bifidobacteria of Indian human origin. J Appl Microbiol. 2016; 120(4):1021-32. [DOI:10.1111/jam.13086] [PMID]
22.Diguta CF, Nitoi GD, Matei F, Luta G, Cornea CP. The biotechnological potential of pediococcus spp.isolated from kombucha microbial consortium. Foods. 2020; 9(12):1780. [DOI:10.3390/foods9121780] [PMID] [PMCID]
23.Belviso S, Giordano M, Dolci P, Zeppa G. In vitro cholesterol-lowering activity of Lactobacillus plantarum and Lactobacillus paracasei strains isolated from the Italian castelmagno pdo cheese. Dairy Sci Technol. 2009; 89(2):169-76. [DOI:10.1051/dst/2009004]
24.Bacha K, Mehari T, Ashenafi M. In-vitro probiotic potential of lactic acid bacteria isolated from wakalim, a traditional ethiopian fermented beef sausage. Ethiop J Health Sci. 2009; 19(1):21-7. https://www.ajol.info/index.php/ejhs/article/view/145938
25.Gilliland SE, Walker DK. Factors to consider when selecting a culture of Lactobacillus acidophilus as a dietary adjunct to produce a hypocholesterolemic effect in humans. J Dairy Sci. 1990; 73(4):905-11. [DOI:10.3168/jds.S0022-0302(90)78747-4]
26.Gopal PK, Prasad J Smart J, Gill HS. In vitro adherence properties of Lactobacillus rhamnosus dr20 and Bifidobacterium lactis dr10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli. Int J Food Microbiol. 2001; 67(3):207-16. [DOI:10.1016/S0168-1605(01)00440-8]
27.Fuochi V, Coniglio MA, Laghi L, Rescifina A, Caruso M, Stivala A, et al. Metabolic characterization of supernatants produced by Lactobacillus spp. With In vitro Anti-legionella activity. Front Microbiol. 2019; 10:1403. [DOI:10.3389/fmicb.2019.01403] [PMID] [PMCID]
28.Saberian M, Shahidi Delshad E, Hbibi M. The effect of Bifidobacterium bifidum supernatant and cell mass on the proliferation potential of rat bone marrow-derived stromal cells. Iran J Med Sci. 2020; 45(4):269-76. [PMCID]
29.Sharma G, Dang S, Gupta S, Gabrani R. Identification and molecular characterization of bacteria having antimicrobial and antibiofilm activity. Int J Pharm Pharm Sci. 2016; 8(10):111-4. [DOI:10.22159/ijpps.2016v8i10.12338]
30.Dimkic I, Stankovic S, Nisavic M, Petkovic M, Ristivojevic P, Fira D, et al. The profile and antimicrobial activity of Bacillus lipopeptide extracts of five potential biocontrol strains. Front Microbiol. 2017; 8:925. [DOI:10.3389/fmicb.2017.00925] [PMCID]
31.Sarikhani Z, Nazari R, Nateghi Rostami M. First report of oxa-143-lactamase producing Acinetobacter baumannii in Qom, Iran. Iran J Basic Med Sci. 2017; 20(11):1282-86. [PMCID]
32.Balouiri M, Sadiki M, Ibnsouda SK. Method for in vitro evaluating antimicrobial activity: A review. J Pharm Anal. 2016; 6(2):71-9. [DOI:10.1016/j.jpha.2015.11.005] [PMID] [PMCID]
33.Sacco F, Visca P, Runci F, Antonelli G, Raponi G. Susceptibility testing of colistin for Acinetobacter baumannii: How far are we from the truth. Antibiotics. 2021; 10(1):48. [DOI:10.3390/antibiotics10010048] [PMID] [PMCID]
34.Hetta HF, Al-kadmy IMS, Khazaal SS, Abbas S, Suhail A, El-mokhtar MA, et al. Antibiofilm and antivirulence potential of silver nanoparticles against multidrug-resistant Acinetobacter baumannii. Sci Rep. 2021; 11(1):10751. [DOI:10.1038/s41598-021-90208-4] [PMID] [PMCID]
35.Jayathilaka EHTT, Rajapaksha DC, Nikapitiya C, De zoysa M, Whang I. Antimicrobial and anti-biofilm peptide octominin for controlling multidrug-resistant Acinetobacter baumannii. Int J Mol Sci. 2021; 22(10):5353. [DOI:10.3390/ijms22105353] [PMID] [PMCID]
36.Longo F, Vuotto C, Donelli F. Biofilm formation in Acinetobacter baumannii. New Microbiol. 2014; 37(2):119-27. [PMID]
37.Monem S, Furmanek Blaszk B, Lupkowska A, Kuczynska Wisnik D, Stojowska Swedrzynska K, Laskowska E. Mechanisms protecting Acinetobacter baumannii against multiple stresses triggered by the host immune response, antibiotics and outside-host environment. Int J Mol Sci. 2020; 21(15):5498. [DOI:10.3390/ijms21155498] [PMID] [PMCID]
38.Karley D, Shukla SK, Toleti SR. Anti-biofilm activity of Bacillus licheniformis culture supernatant against Staphlococcus aureus and Pseudomonas aeruginosa. In International Conference on Recent Trends in Biosciences (ICRTB 2016), 2016 April 7-10. India. https://www.researchgate.net/publication/311675394
39.Abu sayem SM, Manzo E, Ciavatta L, Tramice A, Cordone A, Zanfardino A , et al. Anti-biofilm activity of an exopolysaccharide from a sponge-associated strain of Bacillus licheniformis. Microb Cell Fact. 2011; 10:74. [DOI:10.1186/1475-2859-10-74] [PMID] [PMCID]
40.Skerniskyt J, Karazijait E, Luciunait A, Suziedelien E. OmpA protein-deficient Acinetobacter baumannii outer membrane vesicles trigger reduced inflammatory response. Pathogens. 2021; 10(4):407. [DOI:10.3390/pathogens10040407] [PMID] [PMCID]
41.Na SH, Jeon H, Oh MH, Kim YJ, Lee JC. Screening of small molecules attenuating biofilm formation of acinetobacter baumannii by inhibition of ompA promoter activity. J Microbiol. 2021; 59(9):871-78. [DOI:10.1007/s12275-021-1394-z] [PMID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
