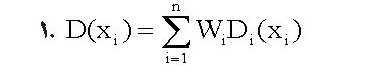دوره 22، شماره 6 - ( بهمن و اسفند 1398 )
جلد 22 شماره 6 صفحات 287-274 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ahmadi Ganjeh Z, Eslami-Kalantari M, Mowlavi A A. The Effect of Phantom Compositions on Dose Calculations in Proton Therapy of Liver Cancer. J Arak Uni Med Sci 2020; 22 (6) :274-287
URL: http://jams.arakmu.ac.ir/article-1-6178-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6178-fa.html
احمدی گنجه زهرا، اسلامی کلانتری محمد، مولوی علی اصغر. تأثیر عناصر تشکیلدهنده فانتوم بر محاسبات دز در پروتونتراپی سرطان کبد. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (6) :274-287
1- گروه هسته ای، دانشکده فیزیک، پردیس علوم پایه، دانشگاه یزد، یزد، ایران.
2- گروه هسته ای، دانشکده فیزیک، پردیس علوم پایه، دانشگاه یزد، یزد، ایران. ،meslami@yazd.ac.ir
3- گروه فیزیک، دانشکده علوم پایه، پردیس علوم پایه، دانشگاه حکیم سبزواری، سبزوار، ایران.
2- گروه هسته ای، دانشکده فیزیک، پردیس علوم پایه، دانشگاه یزد، یزد، ایران. ،
3- گروه فیزیک، دانشکده علوم پایه، پردیس علوم پایه، دانشگاه حکیم سبزواری، سبزوار، ایران.
متن کامل [PDF 6093 kb]
(1835 دریافت)
| چکیده (HTML) (4975 مشاهده)
تشکیل قله براگ پهنشده به دو صورت انجام میگیرد: الف) پراکندگی منفعل: در این روش پرتو با استفاده از ورقههای نازک با اعدد اتمی بالا پراکنده میشود مثل سرب که درنهایت منجر به بیشترین پراکندگی و کمترین کاهش انرژی میشود. درواقع با قراردادن مدولاتور حجم تومور را پوشش میدهند. مدولاتورها در انواع متفاوت ساخته و به کار گرفته میشوند. اگر هدف، یک حجم بزرگ باشد از چرخ مدولاتور و یا از فیلتر شیاردار استفاده میشود. زمانی که چرخ مدولاتور در جلوی باریکه میچرخد، گامها پیدرپی تحت تابش قرار میگیرند. ضخامت هر گام، برد انتقال یافته از پیک اولیه را تعیین میکند. برای اینکه یک SOBP صاف ساخته شود، بهتدریج ضخامت گامها افزایش پیدا میکند. ضخامت و طول گامها به گونهای بهینهسازی میشوند که بهترین قله براگ پهنشده ایجاد شود [10، 11].
ب) روبش قلمی: روش دیگری که میتوان از آن برای پوشش هدف در پروتوندرمانی استفاده کرد روبش فعال است. در این روش دز به صورت لایهلایه به هدف تحویل داده میشود و یا به عبارت دیگر میتوان گفت که تومور به صورت لایهای توسط باریکه جاروب (روبش) میشود. در روش روبش فعال بر خلاف روش پراکندگی منفعل سیستم انتقال باریکه و هدف ثابت (منفعل) نیستند و به ازای هر لایه پرتوگیری، سیستم انتقال و یا هدف، یکبار و یا چندینبار تغییر میکند. با نفوذ در ماده، ذره دستخوش تعداد زیادی پراکندگی عمدتاً کشسان کولنی با هستههای اتمی میشود [11-15]. علاوه بر برهمکنشهای کولنی پروتونها با الکترونهای اتمی و همچنین پراکندگی هستهای کشسان، پروتونها دستخوش پراکندگیهای ناکشسان هستهای نیز میشوند، که طی آن ذرات ثانویه نظیر نوترون، فوتون، پروتونهای ثانویه، دوترون و غیره تولید میشوند که در انرژیهای نه چندان بالای پروتون، نوترون و فوتون از اهمیت بیشتری برخوردارند. نوترونها و فوتونها میتوانند به نقاط دور از بافت هدف برسند و انرژی خود را در بافتهای دور از هدف ذخیره کنند.
ذرات ثانویه دو منشأ متفاوت دارند که میتوانند موجب افزایش ریسک سرطانهای ثانویه شوند؛ یکی ذرات ثانویه تولیدشده در سیستمهای انتقال، پیش از ورود باریکه به بدن که میتوان تا حدودی با قراردادن حفاظهای مناسب نسبت به حذف آنها اقدام کرد و دیگری ذرات ثانویه ناشی از برهمکنشهای هستهای باریکه فرودی با بافت بدن، که با تکنیکهای مکانیکی نمیتوان آنها را حذف کرد و تنها گزینه پیشرو، محاسبه دز دریافتی بافت در اثر این پرتوها جهت تخمین میزان ریسک سرطانهای ثانویه است. ذرات ثانویه تولیدی در بدن بر اندامهای اطراف هدف اثر میگذارند و بنابراین تأثیر بسزایی در میزان دز معادل دارند [16-19].
کبد بزرگترین غده بدن است که در فرایند پروتئینسازی و دفع سموم از بدن، نقش مهمی ایفا میکند. چنانچه سلولهای کبدی آسیب ببیند، رشد بیش از اندازه سلولهای کبد، باعث ایجاد تومورهای سرطانی شده و فعالیت طبیعی کبد را مختل میکند. این نوع سرطان یکی از رایجترین سرطانها در سراسر دنیا محسوب میشود و استفاده از یک روش درمانی مناسب از اهمیت بسزایی برخوردار است. جراحی برای این نوع تومور تنها برای تعداد محدودی از بیماران امکانپذیر است و شیمیدرمانی نیز به دلیل سمیت بالقوه و عوارض جانبی برای این نوع تومور ضعیف است. رادیوتراپی بیش از سه دهه است که برای درمان توموهاری کبدی استفاده شده است. با توجه به حساسیتهایی که برای تومورهای کبدی وجود دارد با در نظر گرفتن دستگاه گوارشی و مجاری صفراوی که نزدیک بافت کبد هستند، انتخاب روش پرتودرمانی مناسب بسیار مهم است.
در میان روشهای مختلف، پروتوندرمانی به دلیل واگذاری بیشترین انرژی پرتو در قله براگ و داشتن برد کوتاه، بر سایر روشها برای درمان سرطان کبد برتری دارد. تحقیقات زیادی در کشورهایی از جمله آمریکا و ژاپن برای استفاده از پروتونتراپی برای درمان سرطان کبد انجام گرفته و بیمارانی تحت درمان قرار گرفتهاند [20-23]. شبیهسازی قبل از درمان نقش مهمی در بهبود کیفیت درمان دارد و میتوان با شبیهسازی اجزای بدن انسان و شرایط درمانی به پیشبینی نتایج درمانی پرداخت.
به دستگاه یا الگوی آزمایشیای که بدن انسان یا قسمتی از بدن انسان را شبیهسازی میکند فانتوم میگویند. فانتومهای محاسباتی انسان مدلهایی از بدن انسان است که در آنالیز رایانهای استفاده میشود و از دهه 1960، انجمن علوم رادیولوژی مدلهای انسانی را برای مطالعات دزیمتری پرتوهای یونیزه ساخته و به کار گرفته است. این مدلها با توجه به ساختار داخلی بدن انسان به طور فزایندهای دقیقتر شدهاند. فانتوم انسان MIRD توسط فیشر و اشنایدر در آزمایشگاه ملی (Oak Ridge) در دهه 1960 با 22 عضو داخلی و بیش از 100 زیرمجموعه ایجاد شد [24-26].
در این کار سعی شده است با شبیهسازی کبد در فانتوم کامل بدن انسان (ORNL - MIRD) شرایط مناسب برای درمان با استفاده از روش پروتونتراپی پیشبینی شود. نتایج مربوط به بافت نرم با چشمه به شعاع دو سانتیمتر در منبع [27] به چاپ رسیده است. با توجه به اینکه در بسیاری از کارهای شبیهسازی از یک فانتوم ساده آب و فانتوم بافت نرم به منظور انجام امور دزیمتری استفاده میشود در این کار سه فانتوم بافت نرم، فانتومی که از عناصر واقعی تشکیلدهنده کبد تشکیل شده است و فانتوم آب جهت مشاهده تفاوتها در نظر گرفته شده است. قله براگ پهنشده و پارامترهای ارزیابی دز محاسبه شدند. چگونگی توزیع دز در تومور و نواحی اطراف آن و همچنین دز ناشی از پروتون، نوترون و فوتون جذب شده در تومور و اندامهای سالم اطراف تومور با استفاده از کد مونت کارلوی MCNPX برای هر سه فانتوم محاسبه و به مقایسه نتایج پرداخته شده است.
مواد و روشها
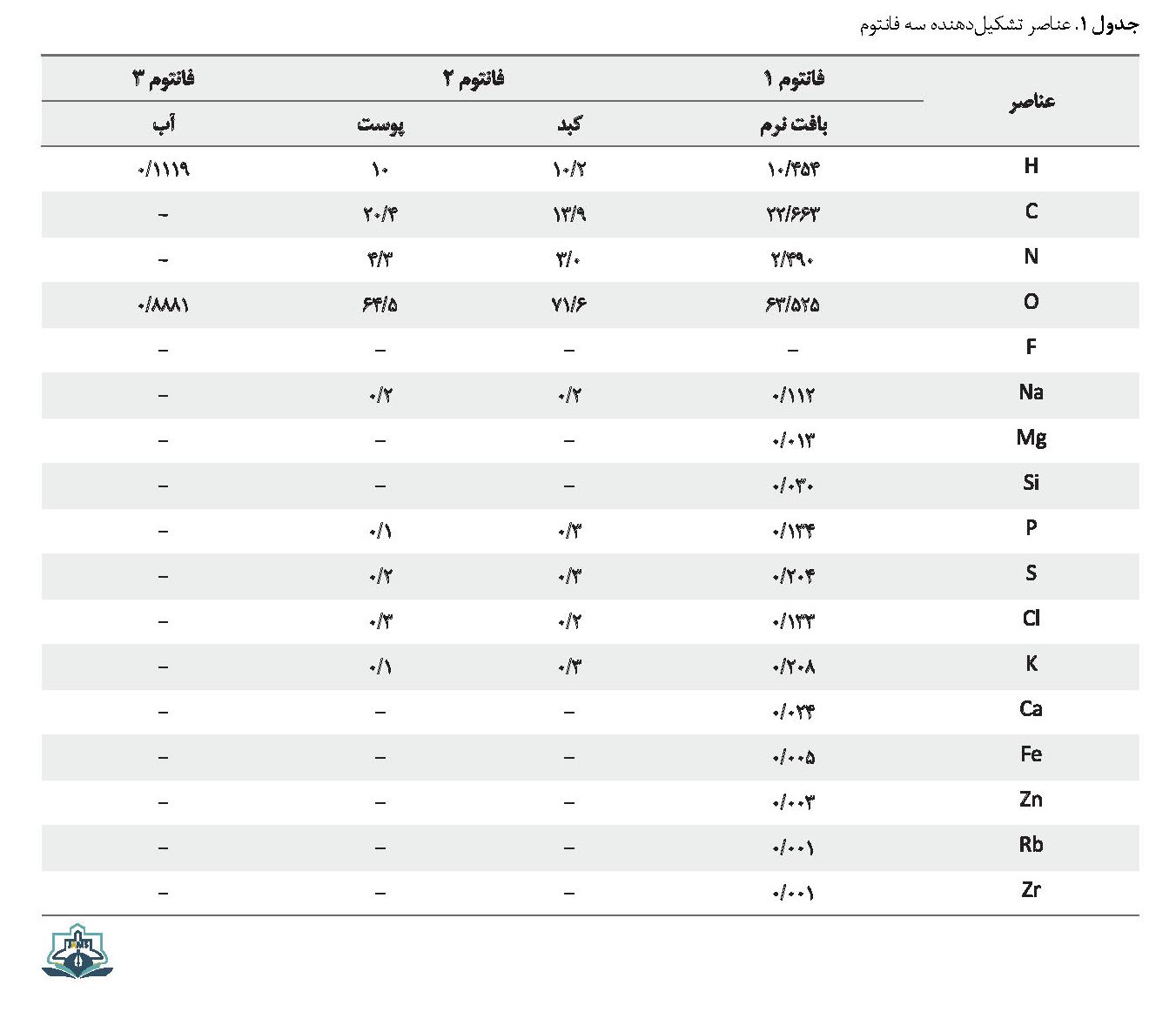
هدف درمانی، به صورت توموری کروی با شعاع دو سانتیمتر در کبد که درون فانتوم کامل بدن انسان قرار دارد در نظر گرفته شد. نمایی از فانتوم کامل بدن انسان در تصویر شماره 1 نشان داده شده است. این تومور در امتداد محور افقی با فانتوم ORNL - MIRD و در جهت منفی این محور در عمق cm 14- تا cm 10- قرار دارد. در اولین مرحله برای به دست آوردن قلههای براگ در محدوده تومور، چشمه پروتون به صورت تکانرژی و عمود بر فانتوم در نظر گرفته شد و انرژی با گامMeV 2 تغییر داده شد. فانتوم 1 از بافت نرم، فانتوم 2 از عناصر واقعی کبد و فانتوم 3 از آب تشکیل شده است. عناصر تشکیلدهنده فانتومها در جدول شماره 1 آورده شدهاند [28].
محاسبه دز رسیده به تومور و دز رسیده به اندامهای بدن به دز رسیده به تومور
در این قسمت دز تخلیهشده ناشی از پروتون، نوترون و فوتون در تومور و بسیاری از اندامهای بدن برای سه فانتوم محاسبه شده و در و در جدول شماره 4 نشان داده شده است. محاسبات با استفاده از تالی شش انجام شده است. برای عضو کبد حجم قسمت تومور از آن کم شده و فقط قسمت سالم کبد در نظر گرفته شده است. دادههای مربوط به دز تخلیه شده در اعضای بدن برای SOBPها به دست آمدهاند. برای مقایسه بهتر نسبت دز رسیده به سایر اجزای بدن به تومور محاسبه شده و در تصویر شماره 7 نشان داده شده است.
References
Doyen J, Falk AT, Floquet V, Herault J, Hannoun-Levi JM. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treat Rev. 2016; 43:104-12. [DOI:10.1016/j.ctrv.2015.12.007] [PMID]
Larsson B. Proton and heavy ion therapy. Exp Suppl. 1975; 24:414-8. [DOI:10.1007/978-3-0348-5520-4_88] [PMID]
Suit H, DeLaney T, Goldberg S, Paganetti H, Clasie B, Gerweck L, et al. Proton vs carbon ion beams in the definitive radiation treatment of cancer patients. Radiother Oncol. 2010; 95(1):3-22. [DOI:10.1016/j.radonc.2010.01.015] [PMID]
Levin WP, DeLaney TF. Chapter 19 - Charged particle radiotherapy. In: Gunderson LL, Tepper JE, editors. Clinical Radiation Oncology (Third Edition). Philadelphia: W.B. Saunders. 2012: 361-76. [DOI:10.1016/B978-1-4377-1637-5.00019-5]
Seif F, Bayatiani MR. Cancer and radiotherapy. J Arak Univ of Med Sci. 2018; 21(4):1-5.
Wilson RR. Radiological use of fast protons. Radiology. 1946; 47(5):487-91. [DOI:10.1148/47.5.487] [PMID]
Peschel RE. Notice: recently published book: proton therapy and radiosurgery, H. Breuer, B.J. Smit, springer-verlag; 2000. Int J Cancer. 2000; 90(2):112. [DOI:10.1002/(SICI)1097-0215(20000420)90:23.0.CO;2-X]
Khan FM. The physics of radiation therapy. Philadelphia: Lippincott Williams & Wilkins; 2010.
Lawrence JH, Tobias CA, Born JL, McCombs RK, Roberts JE, Anger HO, et al. Pituitary irradiation with high-energy proton beams: A preliminary report. Cancer Res. 1958; 18(2):121-34. [PMID]
Abril I, de Vera P, Garcia-Molina R, Kyriakou I, Emfietzoglou D. Lateral spread of dose distribution by therapeutic proton beams in liquid water. : Nucl Instrum Methods Phys Res B. 2015; 352:176-80. [DOI:10.1016/j.nimb.2014.11.100]
Paganetti H. Proton Beam therapy. Florida: CRC Press. 2016. [DOI:10.1088/978-0-7503-1370-4ch1]
Klodowska M, Olko P, Waligorski MP. Proton microbeam radiotherapy with scanned pencil-beams--Monte Carlo simulations. Phys Med. 2015; 31(6):621-6. [DOI:10.1016/j.ejmp.2015.04.006] [PMID]
Paganetti H. Proton Beam therapy. Florida: CRC Press. 2016. [DOI:10.1088/978-0-7503-1370-4ch1]
Bonfrate A, Farah J, De Marzi L, Delacroix S, Herault J, Sayah R, et al. Influence of beam incidence and irradiation parameters on stray neutron doses to healthy organs of pediatric patients treated for an intracranial tumor with passive scattering proton therapy. Physica Med. 2016; 32(4):590-9. [DOI:10.1016/j.ejmp.2016.03.009] [PMID]
Moteabbed M, Yock TI, Depauw N, Madden TM, Kooy HM, Paganetti H. Impact of spot size and beam-shaping devices on the treatment plan quality for pencil beam scanning proton therapy. Int J Radiat Oncol Biol Phys. 2016; 95(1):190-8. [DOI:10.1016/j.ijrobp.2015.12.368] [PMID] [PMCID]
Schneider U, Agosteo S, Pedroni E, Besserer J. Secondary neutron dose during proton therapy using spot scanning. Int J Radiat Oncol Biol Phys. 2002; 53(1):244-51. [DOI:10.1016/S0360-3016(01)02826-7]
Schneider U, Halg RA, Lomax T. Neutrons in active proton therapy: Parameterization of dose and dose equivalent. Z Med Phys. 2017; 27(2):113-23. [DOI:10.1016/j.zemedi.2016.07.001] [PMID]
Islam MR, Zheng Y, Collums TL, Monson JM, Ahmad S, Benton ER. Measurement and simulation of secondary neutrons from uniform scanning proton beams in proton radiotherapy. Radiat Meas. 2017; 96:8-18. [DOI:10.1016/j.radmeas.2016.11.008]
Agosteo S, Birattari C, Caravaggio M, Silari M, Tosi G. Secondary neutron and photon dose in proton therapy. Radiother Oncol. 1998; 48(3):293-305 [DOI:10.1016/S0167-8140(98)00049-8]
Fukumitsu N, Okumura T, Takizawa D, Makishima H, Numajiri H, Murofushi K, et al. Proton beam therapy for metastatic liver tumors. Radiother Oncol. 2015; 117(2):322-7. [DOI:10.1016/j.radonc.2015.09.011] [PMID]
Arscott WT, Thompson RF, Yin L, Burgdorf B, Kirk M, Ben-Josef E. Stereotactic body proton therapy for liver tumors: Dosimetric advantages and their radiobiological and clinical implications. Phys Imaging Radiat Oncol. 2018; 8:17-22. [DOI:10.1016/j.phro.2018.11.004]
Hong TS, DeLaney TF, Mamon HJ, Willett CG, Yeap BY, Niemierko A, et al. A prospective feasibility study of respiratory-gated proton beam therapy for liver tumors. Pract Radiat Oncol. 2014; 4(5):316-22. [DOI:10.1016/j.prro.2013.10.002] [PMID] [PMCID]
Chuong M, Kaiser A, Molitoris J, Romero AM, Apisarnthanarax S. Proton beam therapy for liver cancers. J Gastrointest Oncol. 2020; 11(1). [DOI:10.21037/jgo.2019.04.02]
Gualdrini G, Ferrari P. Handbook of anatomical models for radiation dosimetry. Radiation protection dosimetry. 2011; 143(1):125-7. [DOI:10.1093/rpd/ncq333]
Report of the task group on reference man ICRP Publication 23 (1975). Ann ICRP. 1980; 4(3-4). [DOI:10.1016/0146-6453(80)90047-0]
Snyder WS, Fisher HL Jr, Ford MR, Warner GG. Estimates of absorbed fractions for monoenergetic photon sources uniformly distributed in various organs of a heterogeneous phantom. J Nuc Med. 1969; (Suppl. 3):7-52. [PMID]
Ahmadi Ganjeh Z, Eslami-Kalantari M, Mowlavi AA. Dosimetry calculations of involved and noninvolved organs in proton therapy of liver cancer: A simulation study. Nucl Sciand Tech. 2019; 30(12):173. [DOI:10.1007/s41365-019-0698-8]
White DR, Booz J, Griffith RV, Spokas JJ, Wilson IJ. Report 44. Journal of the International Commission on Radiation Units and Measurements. 2016; 23(1). [DOI:10.1093/jicru/os23.1.Report44]
Prescribing, Recording, And Reporting Proton-Beam Therapy: Contents. J Int Comm Radiat Units Meas. 2007; 7(2). [DOI:10.1093/jicru/ndm021]
متن کامل: (3852 مشاهده)
مقدمه
سرطان به عنوان یکی از مهمترین عوامل مرگومیر در جوامع امروزی، به مجموعه بیماریهایی اطلاق میشود که از تکثیر مهارنشده سلولها پدید میآیند. انتخاب روش درمانی مناسب باید بر اساس اهداف قابل دسترسی و عملی برای هر نوع سرطان انجام گیرد. درمان سرطان امروزه به سمت روشهایی پیش میرود که با کمترین عارضه، بیشترین اثربخشی را داشته باشد.تولید داروهایی مناسبتر و اصلاح روشهای جراحی و رادیوتراپی از جمله این روشها هستند.
با توجه به کاستیهای مربوط به روشهای جراحی و شیمیدرمانی، رادیوتراپی به عنوان یکی از کاربردیترین روشهای درمان سرطان در بهکارگیری پرتوها جهت از بین بردن تومور و از بین بردن حداکثری سلولهای سرطانی است؛ به طوری که کمترین آسیب به بافتهای سالم اطراف تومور برسد. پرتودرمانی همچنین میتواند قبل از عمل جراحی برای کاهش حجم تومور و یا بعد از جراحی برای از بین بردن بقایای تومور و جلوگیری از رشد مجدد تومور به کار برود. علاوه بر این، میتواند اثر شیمیدرمانی را افزایش دهد و برای تومورهای حساس، قبل، بعد و همزمان با شیمیدرمانی استفاده شود.
در پرتودرمانی بهکارگیری روشی که بیشرین تأثیر بر درمان تومور، و افزایش طول عمر بیمار و کمترین عوارض جانبی را به دنبال داشته باشد، از اهمیت زیادی برخوردار است. از مهمترین روشهای پرتودرمانی، پرتودرمانی خارجی است. اساس روش پرتودرمانی خارجی، استفاده از انواع مختلف منابع پرتوهای یوننده است که در خارج از بدن بیمار قرار میگیرد. در این نوع پرتودرمانی منبع پرتوزا میتواند شامل الکترون، نوترون، فوتون و یا ذرات سنگین باردار باشد. مهمترین مزیت ذرات باردار در درمان نسبت به سایر ذرات، برد دقیق این ذرات است.
پروتونهای پرانرژی را که وارد ماده میشوند و پس از برخورد با الکترونهای اتمی و پراکندگی از هستههای اتمی متوقف میشوند ذرات اولیه، و ذراتی را که از برهمکنشهای هستهای کشسان و ناکشسان تولید میشوند ذرات ثانویه مینامند. منحنی مربوط به مقایسه توزیع دز عمقی نشان میدهد که توزیع دز برای فوتونها به صورت نمایی کاهش مییابد ولی پروتونها و کربنها تا رسیدن به انتهای مسیر خود انرژی ناچیزی را از دست داده و بیشینه انرژی خود را در نقطه براگ از دست میدهند [1-5]. در سال 1940 فیزیکدانان در دانشگاه هاروارد پیشنهاد کردند که از پروتونهای با انرژی بالا برای پرتودرمانی استفاده شود و در سال 1946 ویلسون توزیع عمق دز پروتونهای سریع داخل جسم را با جزئیات بیشتری توصیف کرد [6].
محدودیت استفاده از پرتوهای پروتون باعث شد که تحقیقات پزشکی چند سال به تعویق بیفتد و اولین استفاده پزشکی از باریکه پروتون در سال 1954 در آزمایشگاه برکلی شروع شد. دانشمندان در برکلی از جمله توبیاس تحقیقات بیولوژیکی گستردهای را روی باریکه پروتون آغاز کردند و در ادامه تحقیقات پزشکی، اولین اندامی که تحت تابش پروتون قرار گرفت غده هیپوفیز بود. توبیاس و همکارانش برای اولینبار در سال 1955 در آزمایشگاه لارنس برکلی بیماران را با پروتون درمان کردند.
سیکلوترون جدید در دانشگاه آپسالا در سوئد، تحقیقاتی که در آزمایشگاه برکلی در سال ۱۹۵۴در زمینه پرتودرمانی مغز آغاز شده بود را گسترش داد و پیشرو استفاده از پهنشدگی قله براگ برای درمان تومورهای بزرگ بود [7-9]. درواقع بیشترین تکنیک پروتونتراپی متکی به قابلیت دستکاری بر روی قله براگ است. هدف از این دستکاریها این است که هدفهای بزرگ پوششدهی شوند. به گونهای که بافت سالم تا حد ممکن پرتو دریافت نکند. پهنای قله، مربوط به یک باریکه تکانرژی پروتون، بسته به انرژی و محیط، 4 تا 7 میلیمتر است. پهنای محدود قلهی براگ بهتنهایی مفید نیست. مگر اینکه طول هدف فقط چند میلیمتر باشد. فیزیکدانان به واسطه تجمع قلههایی با انرژیهای متفاوت میتوانند یک قله براگ پهنشده را تولید کنند که از آن برای درمان تومورهای بزرگ استفاده میکنند. قله براگ پهنشده برای ایجاد یک توزیع دز یکنواخت در حجم هدف به کار میرود.
به منظور ایجاد SOBP چندین قله براگ با بردهای مختلف، متناظر با انرژیهای ورودی متفاوت و با وزنهای معین ترکیب میشوند. دز SOBP در عمق xi از فرمول شماره 1 به دست میآید که در آن n تعداد سهمها در توزیع براگ، Wi شدت نسبی i امین باریکه (وزن باریکه) و Di دز در xi برای i امین توزیع براگ است.
سرطان به عنوان یکی از مهمترین عوامل مرگومیر در جوامع امروزی، به مجموعه بیماریهایی اطلاق میشود که از تکثیر مهارنشده سلولها پدید میآیند. انتخاب روش درمانی مناسب باید بر اساس اهداف قابل دسترسی و عملی برای هر نوع سرطان انجام گیرد. درمان سرطان امروزه به سمت روشهایی پیش میرود که با کمترین عارضه، بیشترین اثربخشی را داشته باشد.تولید داروهایی مناسبتر و اصلاح روشهای جراحی و رادیوتراپی از جمله این روشها هستند.
با توجه به کاستیهای مربوط به روشهای جراحی و شیمیدرمانی، رادیوتراپی به عنوان یکی از کاربردیترین روشهای درمان سرطان در بهکارگیری پرتوها جهت از بین بردن تومور و از بین بردن حداکثری سلولهای سرطانی است؛ به طوری که کمترین آسیب به بافتهای سالم اطراف تومور برسد. پرتودرمانی همچنین میتواند قبل از عمل جراحی برای کاهش حجم تومور و یا بعد از جراحی برای از بین بردن بقایای تومور و جلوگیری از رشد مجدد تومور به کار برود. علاوه بر این، میتواند اثر شیمیدرمانی را افزایش دهد و برای تومورهای حساس، قبل، بعد و همزمان با شیمیدرمانی استفاده شود.
در پرتودرمانی بهکارگیری روشی که بیشرین تأثیر بر درمان تومور، و افزایش طول عمر بیمار و کمترین عوارض جانبی را به دنبال داشته باشد، از اهمیت زیادی برخوردار است. از مهمترین روشهای پرتودرمانی، پرتودرمانی خارجی است. اساس روش پرتودرمانی خارجی، استفاده از انواع مختلف منابع پرتوهای یوننده است که در خارج از بدن بیمار قرار میگیرد. در این نوع پرتودرمانی منبع پرتوزا میتواند شامل الکترون، نوترون، فوتون و یا ذرات سنگین باردار باشد. مهمترین مزیت ذرات باردار در درمان نسبت به سایر ذرات، برد دقیق این ذرات است.
پروتونهای پرانرژی را که وارد ماده میشوند و پس از برخورد با الکترونهای اتمی و پراکندگی از هستههای اتمی متوقف میشوند ذرات اولیه، و ذراتی را که از برهمکنشهای هستهای کشسان و ناکشسان تولید میشوند ذرات ثانویه مینامند. منحنی مربوط به مقایسه توزیع دز عمقی نشان میدهد که توزیع دز برای فوتونها به صورت نمایی کاهش مییابد ولی پروتونها و کربنها تا رسیدن به انتهای مسیر خود انرژی ناچیزی را از دست داده و بیشینه انرژی خود را در نقطه براگ از دست میدهند [1-5]. در سال 1940 فیزیکدانان در دانشگاه هاروارد پیشنهاد کردند که از پروتونهای با انرژی بالا برای پرتودرمانی استفاده شود و در سال 1946 ویلسون توزیع عمق دز پروتونهای سریع داخل جسم را با جزئیات بیشتری توصیف کرد [6].
محدودیت استفاده از پرتوهای پروتون باعث شد که تحقیقات پزشکی چند سال به تعویق بیفتد و اولین استفاده پزشکی از باریکه پروتون در سال 1954 در آزمایشگاه برکلی شروع شد. دانشمندان در برکلی از جمله توبیاس تحقیقات بیولوژیکی گستردهای را روی باریکه پروتون آغاز کردند و در ادامه تحقیقات پزشکی، اولین اندامی که تحت تابش پروتون قرار گرفت غده هیپوفیز بود. توبیاس و همکارانش برای اولینبار در سال 1955 در آزمایشگاه لارنس برکلی بیماران را با پروتون درمان کردند.
سیکلوترون جدید در دانشگاه آپسالا در سوئد، تحقیقاتی که در آزمایشگاه برکلی در سال ۱۹۵۴در زمینه پرتودرمانی مغز آغاز شده بود را گسترش داد و پیشرو استفاده از پهنشدگی قله براگ برای درمان تومورهای بزرگ بود [7-9]. درواقع بیشترین تکنیک پروتونتراپی متکی به قابلیت دستکاری بر روی قله براگ است. هدف از این دستکاریها این است که هدفهای بزرگ پوششدهی شوند. به گونهای که بافت سالم تا حد ممکن پرتو دریافت نکند. پهنای قله، مربوط به یک باریکه تکانرژی پروتون، بسته به انرژی و محیط، 4 تا 7 میلیمتر است. پهنای محدود قلهی براگ بهتنهایی مفید نیست. مگر اینکه طول هدف فقط چند میلیمتر باشد. فیزیکدانان به واسطه تجمع قلههایی با انرژیهای متفاوت میتوانند یک قله براگ پهنشده را تولید کنند که از آن برای درمان تومورهای بزرگ استفاده میکنند. قله براگ پهنشده برای ایجاد یک توزیع دز یکنواخت در حجم هدف به کار میرود.
به منظور ایجاد SOBP چندین قله براگ با بردهای مختلف، متناظر با انرژیهای ورودی متفاوت و با وزنهای معین ترکیب میشوند. دز SOBP در عمق xi از فرمول شماره 1 به دست میآید که در آن n تعداد سهمها در توزیع براگ، Wi شدت نسبی i امین باریکه (وزن باریکه) و Di دز در xi برای i امین توزیع براگ است.
تشکیل قله براگ پهنشده به دو صورت انجام میگیرد: الف) پراکندگی منفعل: در این روش پرتو با استفاده از ورقههای نازک با اعدد اتمی بالا پراکنده میشود مثل سرب که درنهایت منجر به بیشترین پراکندگی و کمترین کاهش انرژی میشود. درواقع با قراردادن مدولاتور حجم تومور را پوشش میدهند. مدولاتورها در انواع متفاوت ساخته و به کار گرفته میشوند. اگر هدف، یک حجم بزرگ باشد از چرخ مدولاتور و یا از فیلتر شیاردار استفاده میشود. زمانی که چرخ مدولاتور در جلوی باریکه میچرخد، گامها پیدرپی تحت تابش قرار میگیرند. ضخامت هر گام، برد انتقال یافته از پیک اولیه را تعیین میکند. برای اینکه یک SOBP صاف ساخته شود، بهتدریج ضخامت گامها افزایش پیدا میکند. ضخامت و طول گامها به گونهای بهینهسازی میشوند که بهترین قله براگ پهنشده ایجاد شود [10، 11].
ب) روبش قلمی: روش دیگری که میتوان از آن برای پوشش هدف در پروتوندرمانی استفاده کرد روبش فعال است. در این روش دز به صورت لایهلایه به هدف تحویل داده میشود و یا به عبارت دیگر میتوان گفت که تومور به صورت لایهای توسط باریکه جاروب (روبش) میشود. در روش روبش فعال بر خلاف روش پراکندگی منفعل سیستم انتقال باریکه و هدف ثابت (منفعل) نیستند و به ازای هر لایه پرتوگیری، سیستم انتقال و یا هدف، یکبار و یا چندینبار تغییر میکند. با نفوذ در ماده، ذره دستخوش تعداد زیادی پراکندگی عمدتاً کشسان کولنی با هستههای اتمی میشود [11-15]. علاوه بر برهمکنشهای کولنی پروتونها با الکترونهای اتمی و همچنین پراکندگی هستهای کشسان، پروتونها دستخوش پراکندگیهای ناکشسان هستهای نیز میشوند، که طی آن ذرات ثانویه نظیر نوترون، فوتون، پروتونهای ثانویه، دوترون و غیره تولید میشوند که در انرژیهای نه چندان بالای پروتون، نوترون و فوتون از اهمیت بیشتری برخوردارند. نوترونها و فوتونها میتوانند به نقاط دور از بافت هدف برسند و انرژی خود را در بافتهای دور از هدف ذخیره کنند.
ذرات ثانویه دو منشأ متفاوت دارند که میتوانند موجب افزایش ریسک سرطانهای ثانویه شوند؛ یکی ذرات ثانویه تولیدشده در سیستمهای انتقال، پیش از ورود باریکه به بدن که میتوان تا حدودی با قراردادن حفاظهای مناسب نسبت به حذف آنها اقدام کرد و دیگری ذرات ثانویه ناشی از برهمکنشهای هستهای باریکه فرودی با بافت بدن، که با تکنیکهای مکانیکی نمیتوان آنها را حذف کرد و تنها گزینه پیشرو، محاسبه دز دریافتی بافت در اثر این پرتوها جهت تخمین میزان ریسک سرطانهای ثانویه است. ذرات ثانویه تولیدی در بدن بر اندامهای اطراف هدف اثر میگذارند و بنابراین تأثیر بسزایی در میزان دز معادل دارند [16-19].
کبد بزرگترین غده بدن است که در فرایند پروتئینسازی و دفع سموم از بدن، نقش مهمی ایفا میکند. چنانچه سلولهای کبدی آسیب ببیند، رشد بیش از اندازه سلولهای کبد، باعث ایجاد تومورهای سرطانی شده و فعالیت طبیعی کبد را مختل میکند. این نوع سرطان یکی از رایجترین سرطانها در سراسر دنیا محسوب میشود و استفاده از یک روش درمانی مناسب از اهمیت بسزایی برخوردار است. جراحی برای این نوع تومور تنها برای تعداد محدودی از بیماران امکانپذیر است و شیمیدرمانی نیز به دلیل سمیت بالقوه و عوارض جانبی برای این نوع تومور ضعیف است. رادیوتراپی بیش از سه دهه است که برای درمان توموهاری کبدی استفاده شده است. با توجه به حساسیتهایی که برای تومورهای کبدی وجود دارد با در نظر گرفتن دستگاه گوارشی و مجاری صفراوی که نزدیک بافت کبد هستند، انتخاب روش پرتودرمانی مناسب بسیار مهم است.
در میان روشهای مختلف، پروتوندرمانی به دلیل واگذاری بیشترین انرژی پرتو در قله براگ و داشتن برد کوتاه، بر سایر روشها برای درمان سرطان کبد برتری دارد. تحقیقات زیادی در کشورهایی از جمله آمریکا و ژاپن برای استفاده از پروتونتراپی برای درمان سرطان کبد انجام گرفته و بیمارانی تحت درمان قرار گرفتهاند [20-23]. شبیهسازی قبل از درمان نقش مهمی در بهبود کیفیت درمان دارد و میتوان با شبیهسازی اجزای بدن انسان و شرایط درمانی به پیشبینی نتایج درمانی پرداخت.
به دستگاه یا الگوی آزمایشیای که بدن انسان یا قسمتی از بدن انسان را شبیهسازی میکند فانتوم میگویند. فانتومهای محاسباتی انسان مدلهایی از بدن انسان است که در آنالیز رایانهای استفاده میشود و از دهه 1960، انجمن علوم رادیولوژی مدلهای انسانی را برای مطالعات دزیمتری پرتوهای یونیزه ساخته و به کار گرفته است. این مدلها با توجه به ساختار داخلی بدن انسان به طور فزایندهای دقیقتر شدهاند. فانتوم انسان MIRD توسط فیشر و اشنایدر در آزمایشگاه ملی (Oak Ridge) در دهه 1960 با 22 عضو داخلی و بیش از 100 زیرمجموعه ایجاد شد [24-26].
در این کار سعی شده است با شبیهسازی کبد در فانتوم کامل بدن انسان (ORNL - MIRD) شرایط مناسب برای درمان با استفاده از روش پروتونتراپی پیشبینی شود. نتایج مربوط به بافت نرم با چشمه به شعاع دو سانتیمتر در منبع [27] به چاپ رسیده است. با توجه به اینکه در بسیاری از کارهای شبیهسازی از یک فانتوم ساده آب و فانتوم بافت نرم به منظور انجام امور دزیمتری استفاده میشود در این کار سه فانتوم بافت نرم، فانتومی که از عناصر واقعی تشکیلدهنده کبد تشکیل شده است و فانتوم آب جهت مشاهده تفاوتها در نظر گرفته شده است. قله براگ پهنشده و پارامترهای ارزیابی دز محاسبه شدند. چگونگی توزیع دز در تومور و نواحی اطراف آن و همچنین دز ناشی از پروتون، نوترون و فوتون جذب شده در تومور و اندامهای سالم اطراف تومور با استفاده از کد مونت کارلوی MCNPX برای هر سه فانتوم محاسبه و به مقایسه نتایج پرداخته شده است.
مواد و روشها
هدف درمانی، به صورت توموری کروی با شعاع دو سانتیمتر در کبد که درون فانتوم کامل بدن انسان قرار دارد در نظر گرفته شد. نمایی از فانتوم کامل بدن انسان در تصویر شماره 1 نشان داده شده است. این تومور در امتداد محور افقی با فانتوم ORNL - MIRD و در جهت منفی این محور در عمق cm 14- تا cm 10- قرار دارد. در اولین مرحله برای به دست آوردن قلههای براگ در محدوده تومور، چشمه پروتون به صورت تکانرژی و عمود بر فانتوم در نظر گرفته شد و انرژی با گامMeV 2 تغییر داده شد. فانتوم 1 از بافت نرم، فانتوم 2 از عناصر واقعی کبد و فانتوم 3 از آب تشکیل شده است. عناصر تشکیلدهنده فانتومها در جدول شماره 1 آورده شدهاند [28].
شبیهسازی درمان با انرژیهای مختلف چشمه انجام شده و طیف براگ پهنشده بهینه، مطابق فرمول شماره 1 برای درمان تومورها تعیین شد. پارامترهای ارزیابی دز طبق گزارش ICRU تعیین شده و مقایسه لازم انجام شده است. این پارامترها طبق تعریف شامل عمق نفوذ، شیب انتهایی دز، طول SOBP و طول هدف است که در ادامه توضیح داده شدهاند.
- عمق نفوذ (d90′): عمق در طول طیف تا نقطه 90 درصد از بیشینه مقدار دز در انتهای طیف.
- شیب انتهایی دز (DDF): فاصلهای است در راستای محور بیم که دز از مقدار 80 درصد به 20 درصد بیشینه مقدار کاهش مییابد.
- طول m90′) SOBP): فاصله بین 90 درصد بیشینه مقدار دز در ابتدا و انتهای طیف.
- طول هدف (درمان): فاصله بین طول DDF از 90 درصد بیشینه مقدار دز لبه ابتدایی و دوبرابر طول DDF از 50 درصد بیشینه مقدار دز در انتهای طیف.
در ادامه، نمودارهای ایزودز برای فوتون و نوترون در ناحیه تومور و اطراف آن با استفاده از مش تالی به منظور مشاهده چگونگی توزیع دز رسم شده است. در پایان دز پروتون، نوترون و گامای جذبشده در تومور و بافت سالم کبد و برخی اندامهای مجاور آن با استفاده از تالی F6 محاسبه شد.
- عمق نفوذ (d90′): عمق در طول طیف تا نقطه 90 درصد از بیشینه مقدار دز در انتهای طیف.
- شیب انتهایی دز (DDF): فاصلهای است در راستای محور بیم که دز از مقدار 80 درصد به 20 درصد بیشینه مقدار کاهش مییابد.
- طول m90′) SOBP): فاصله بین 90 درصد بیشینه مقدار دز در ابتدا و انتهای طیف.
- طول هدف (درمان): فاصله بین طول DDF از 90 درصد بیشینه مقدار دز لبه ابتدایی و دوبرابر طول DDF از 50 درصد بیشینه مقدار دز در انتهای طیف.
در ادامه، نمودارهای ایزودز برای فوتون و نوترون در ناحیه تومور و اطراف آن با استفاده از مش تالی به منظور مشاهده چگونگی توزیع دز رسم شده است. در پایان دز پروتون، نوترون و گامای جذبشده در تومور و بافت سالم کبد و برخی اندامهای مجاور آن با استفاده از تالی F6 محاسبه شد.
یافتهها
نتایج در چند قسمت ارائه شدهاند که شامل به دست آوردن ضریبهای وزنی و رسم SOBP، پارامترهای ارزیابی دز پروتون و نمودارهای همدز برای ذرات ثانویه در ناحیه تومور و اطراف آن است که به ترتیب توضیح داده شدهاند.
به دست آوردن ضریبهای وزنی و رسمSOBP
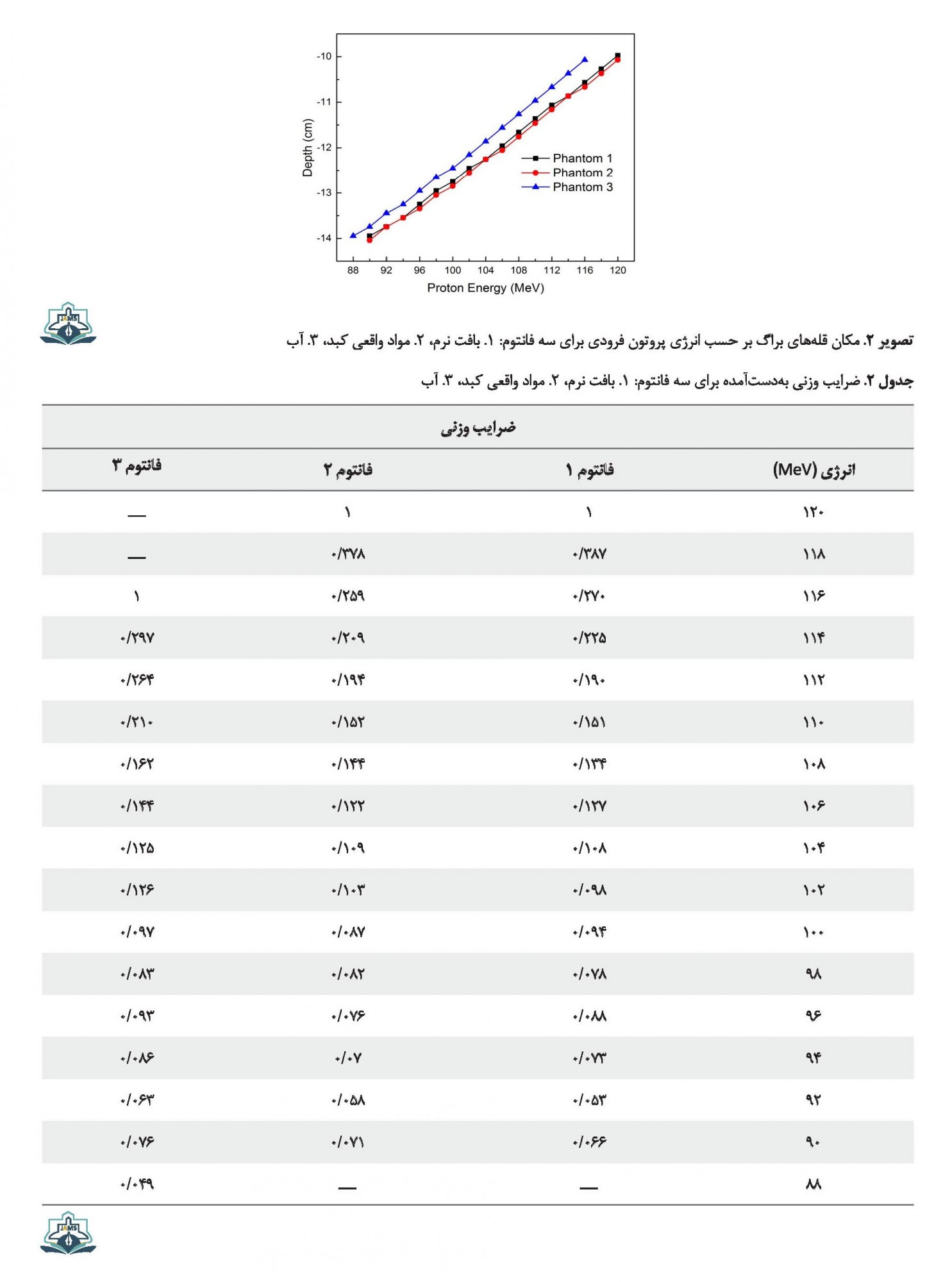
انرژی قلههای براگ و مکانهای مربوط به قلهها در تصویر شماره 2 نشان داده شده است.
برای فانتوم شماره 1 و 2 قلههای براگ در بازهی انرژی 120 MeV - 90 Mev در محدوده تومور و برای فانتوم شماره 3 اولین قله براگ در سطح تومور در انرژی MeV 88 و آخرین قله براگ در محدوده تومور در انرژی MeV 611 است.
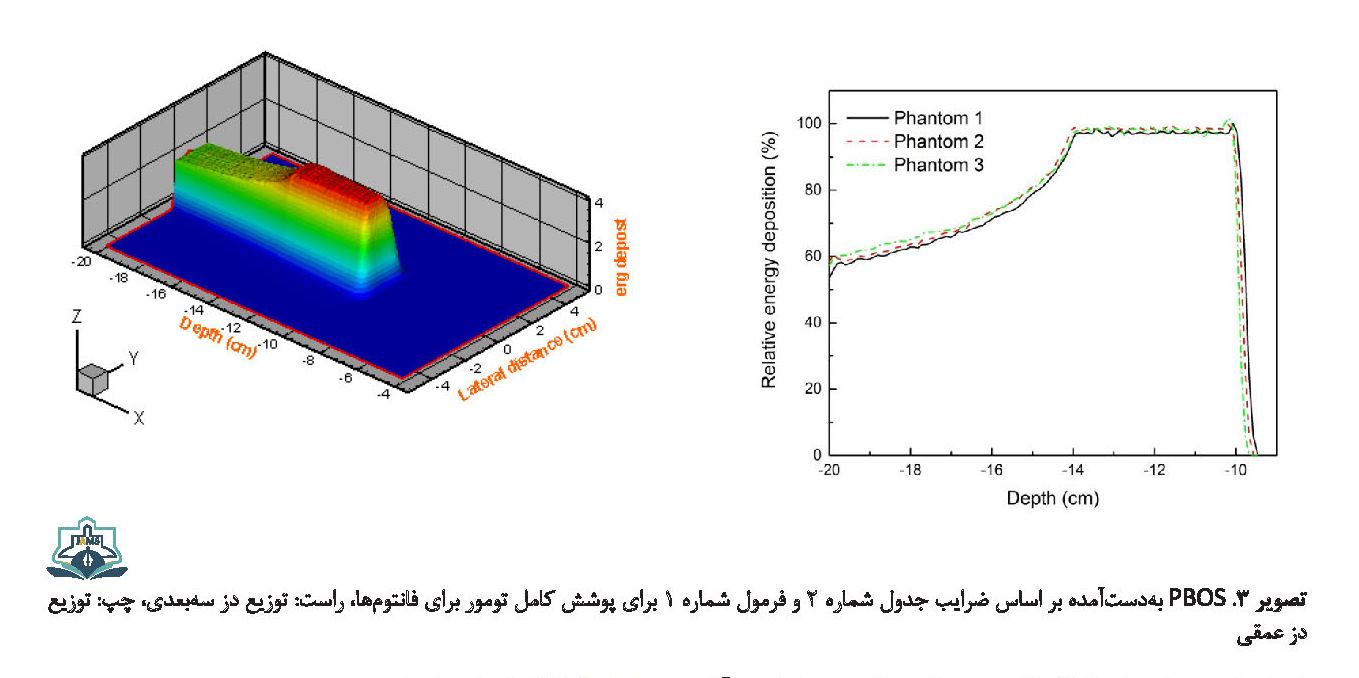
ضرایب وزنی بهدستآمده برای ایجاد توزیع دز یکنواخت در جدول شماره 2 و نمودارهای SOBP مربوط به قلههای براگ برای سه فانتوم در تصویر شماره 3 رسم شده است.
پارامترهای ارزیابی دز پروتون
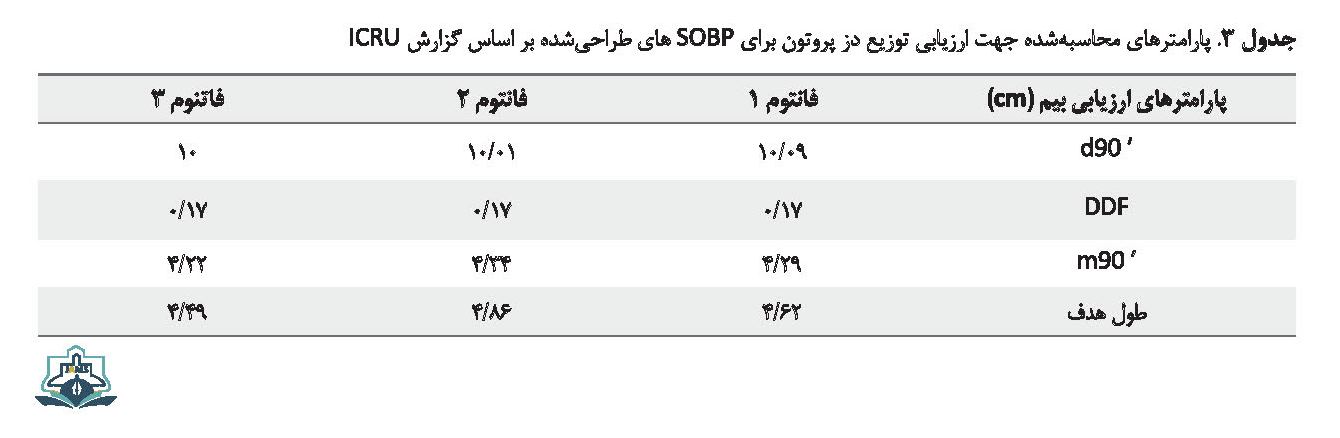
ویژگیهایSOBP ایجادشده با پارامترهای پیشنهادشده به وسیله ICRU [29] ارزیابی میشوند. این پارامترها در جدول شماره 3 نشان داده شده است.
نتایج در چند قسمت ارائه شدهاند که شامل به دست آوردن ضریبهای وزنی و رسم SOBP، پارامترهای ارزیابی دز پروتون و نمودارهای همدز برای ذرات ثانویه در ناحیه تومور و اطراف آن است که به ترتیب توضیح داده شدهاند.
به دست آوردن ضریبهای وزنی و رسمSOBP
انرژی قلههای براگ و مکانهای مربوط به قلهها در تصویر شماره 2 نشان داده شده است.
برای فانتوم شماره 1 و 2 قلههای براگ در بازهی انرژی 120 MeV - 90 Mev در محدوده تومور و برای فانتوم شماره 3 اولین قله براگ در سطح تومور در انرژی MeV 88 و آخرین قله براگ در محدوده تومور در انرژی MeV 611 است.
ضرایب وزنی بهدستآمده برای ایجاد توزیع دز یکنواخت در جدول شماره 2 و نمودارهای SOBP مربوط به قلههای براگ برای سه فانتوم در تصویر شماره 3 رسم شده است.
پارامترهای ارزیابی دز پروتون
ویژگیهایSOBP ایجادشده با پارامترهای پیشنهادشده به وسیله ICRU [29] ارزیابی میشوند. این پارامترها در جدول شماره 3 نشان داده شده است.
نمودارهای همدز برای پروتون، فوتون و نوترون در ناحیه تومور و اطراف آن
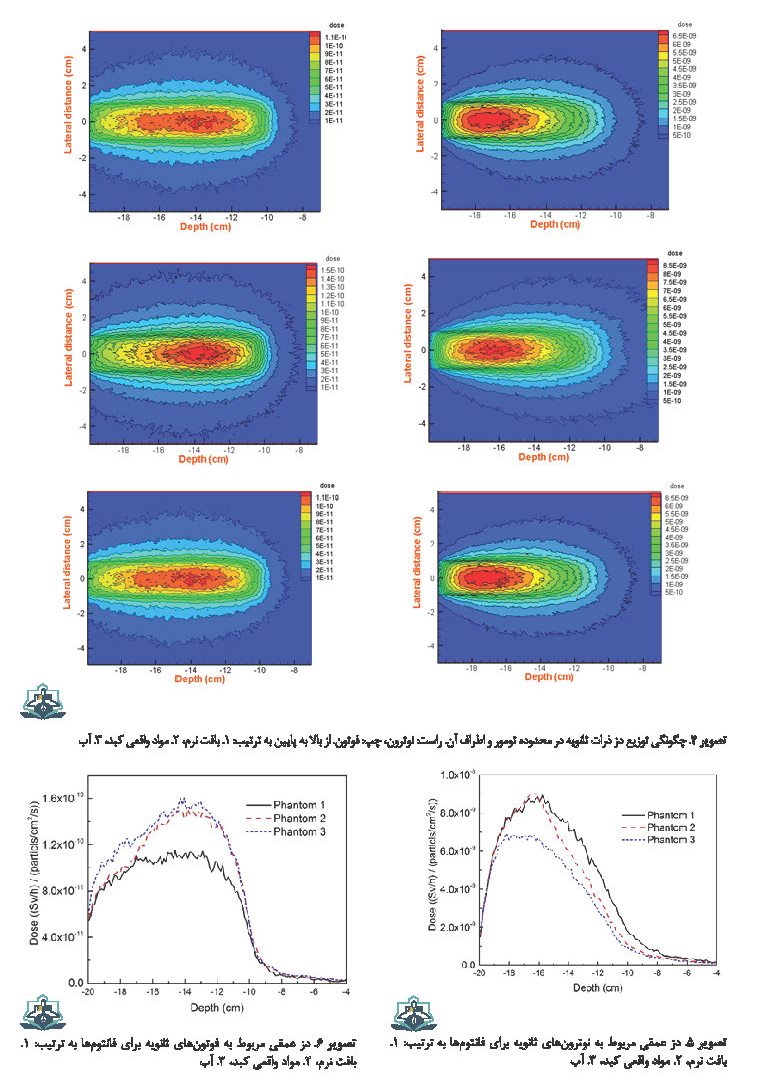
برای دیدن چگونگی توزیع دز در ناحیه تومور و اطراف آن نمودارهای همدز مربوط به ذرات ثانویه نوترون و فوتون با استفاده از مش تالی محاسبه شده و در تصویر شماره 4 نمایش داده شده است. برای مشاهده چگونگی توزیع عمقی دز، نمودارهای مربوط به ذرات ثانویه نوترون در تصویر شماره 5 و نمودار مربوط به ذرات ثانویه فوتون در تصویر شماره 6 نشان داده شده است.
برای دیدن چگونگی توزیع دز در ناحیه تومور و اطراف آن نمودارهای همدز مربوط به ذرات ثانویه نوترون و فوتون با استفاده از مش تالی محاسبه شده و در تصویر شماره 4 نمایش داده شده است. برای مشاهده چگونگی توزیع عمقی دز، نمودارهای مربوط به ذرات ثانویه نوترون در تصویر شماره 5 و نمودار مربوط به ذرات ثانویه فوتون در تصویر شماره 6 نشان داده شده است.
نمودارهای همدز نشان میدهند نوترونها بیشترین مقدار دز خود را در محدوده بافت سالم (کمتر از cm 14-) تخلیه میکنند.نمودارها نشان میدهند فوتونها بخشی از انرژی را در تومور و بخش دیگر را در بافت سالم تخلیه میکنند. بیشترین دز در لبه تومور و در عمق (cm) 14- تخلیه شده است.
محاسبه دز رسیده به تومور و دز رسیده به اندامهای بدن به دز رسیده به تومور
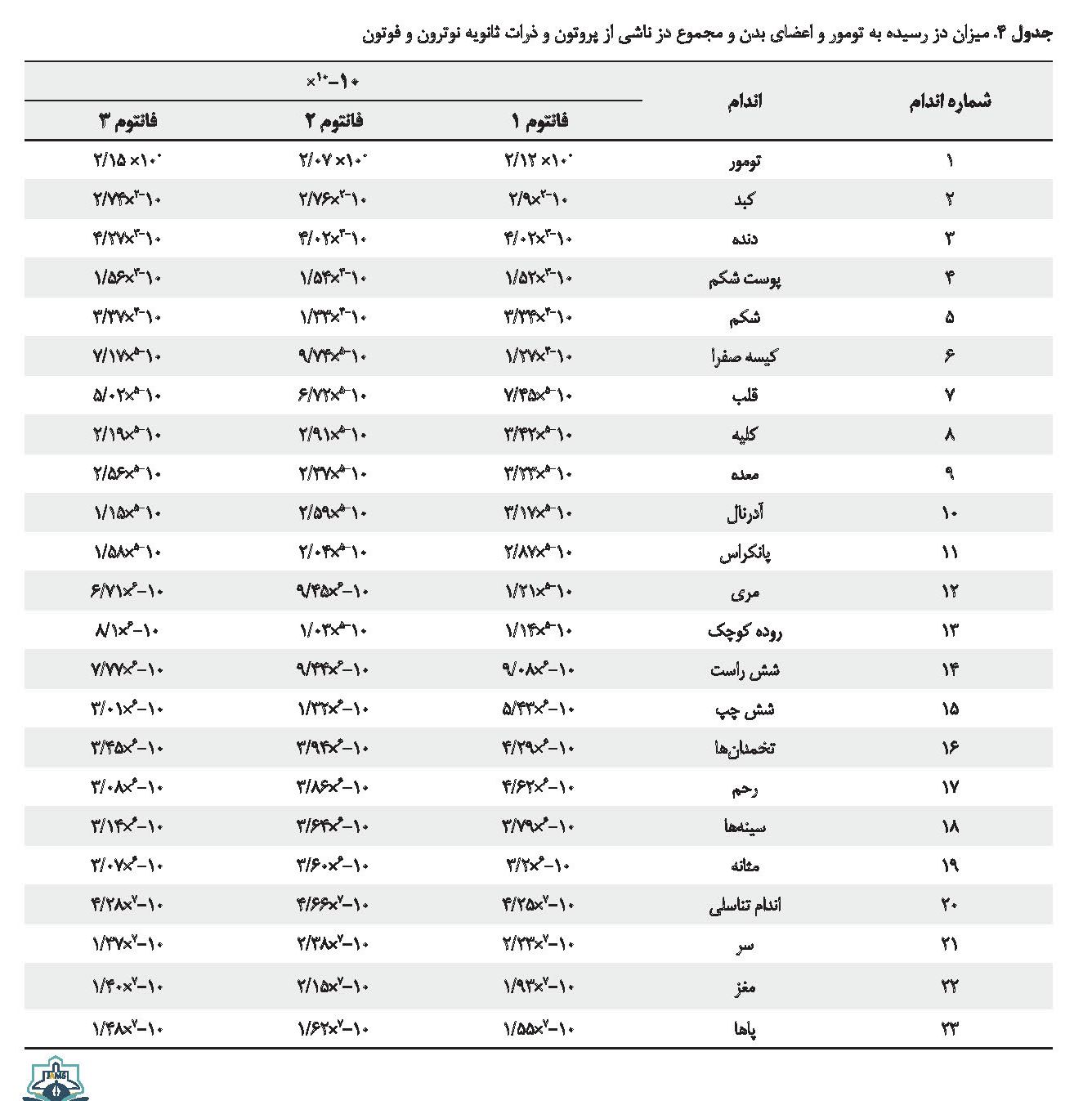
در این قسمت دز تخلیهشده ناشی از پروتون، نوترون و فوتون در تومور و بسیاری از اندامهای بدن برای سه فانتوم محاسبه شده و در و در جدول شماره 4 نشان داده شده است. محاسبات با استفاده از تالی شش انجام شده است. برای عضو کبد حجم قسمت تومور از آن کم شده و فقط قسمت سالم کبد در نظر گرفته شده است. دادههای مربوط به دز تخلیه شده در اعضای بدن برای SOBPها به دست آمدهاند. برای مقایسه بهتر نسبت دز رسیده به سایر اجزای بدن به تومور محاسبه شده و در تصویر شماره 7 نشان داده شده است.
بحث
پروتونتراپی، به دلیل بر جای گذاشتن بیشتر انرژی خود در انتهای مسیر (قله براگ) و توانایی در به دست آوردن یکنواختی توزیع دز در حجم هدف، یک انتخاب مناسب برای تومورهای نزدیک به ارگانهای حساس است. از پروتون برای درمان تومورهای عمقی کبد با دقت بالا استفاده شده و دارای مزیتهای فراوانی نسبت به استفاده از باریکههای فوتون و الکترون است.
استفاده از این روش درمانی برای سرطان کبد با توجه به حساسیتهای این عضو و نزدیکی با ارگانهای مهم بدن در حال گسترش روزافزون است. با توجه به اینکه شبیهسازی پایه و اساس درمانهای کلینیکی برای پیشبینی شرایط درمان است، باید دقت شبیهسازی شرایط درمانی افزایش یابند. بدین منظور در این پژوهش شبیهسازی درمان سرطان کبد با استفاده از روش پروتونتراپی برای سه فانتوم معمول در مطالعات دزیمتری متشکل از بافت نرم، مواد اصلی کبد و آب مورد بررسی قرار گرفت تا بتوان به تفاوتهای این فانتومها در محاسبات اندازهگیری دز دست یافت.
پروتونتراپی، به دلیل بر جای گذاشتن بیشتر انرژی خود در انتهای مسیر (قله براگ) و توانایی در به دست آوردن یکنواختی توزیع دز در حجم هدف، یک انتخاب مناسب برای تومورهای نزدیک به ارگانهای حساس است. از پروتون برای درمان تومورهای عمقی کبد با دقت بالا استفاده شده و دارای مزیتهای فراوانی نسبت به استفاده از باریکههای فوتون و الکترون است.
استفاده از این روش درمانی برای سرطان کبد با توجه به حساسیتهای این عضو و نزدیکی با ارگانهای مهم بدن در حال گسترش روزافزون است. با توجه به اینکه شبیهسازی پایه و اساس درمانهای کلینیکی برای پیشبینی شرایط درمان است، باید دقت شبیهسازی شرایط درمانی افزایش یابند. بدین منظور در این پژوهش شبیهسازی درمان سرطان کبد با استفاده از روش پروتونتراپی برای سه فانتوم معمول در مطالعات دزیمتری متشکل از بافت نرم، مواد اصلی کبد و آب مورد بررسی قرار گرفت تا بتوان به تفاوتهای این فانتومها در محاسبات اندازهگیری دز دست یافت.
قلههای براگ مناسب جهت پوشاندن ناحیه تومور برای سه فانتوم محاسبه شد. نتایج نشان داد که برای فانتوم بافت نرم و بافت تشکیل شده از بافت اصلی کبد، قلههای براگ در بازه انرژی 120 MeV - 90 MeV و برای فانتوم آب در بازه انرژی 116 MeV - 88 MeV در محدوده تومور قرار میگیرند. همچنین نتایج نشان دادند که مکان تخلیه دز برای فانتوم آب در هر انرژی نسبت به دو فانتوم دیگر متفاوت بوده و این تفاوت به صورت تقریبی به اندازه 5/4 میلیمتر در هر نقطه است. نمودار نشان داد مکان تخلیه دز برای فانتوم آب در هر انرژی نسبت به دو فانتوم دیگر متفاوت بوده است. این تفاوتها میتواند ناشی از تفاوت چگالی و عناصر تشکیلدهنده فانتومها نسبت به بافت اصلی کبد باشد.
ضرایب وزنی مناسب برای ایجاد قله پهنشده جهت پوشش کامل تومور برای سه فانتوم محاسبه شد که نتایج نشان داد این ضرایب برای دو فانتوم بافت نرم و کبد تقریباً یکسان و برای فانتوم آب کمی متفاوت است. در فانتوم آب ارتفاع قلهها نسبت به دو فانتوم دیگر، کمتر و ضرایب وزنی به جز در انرژی اول نسبت به دو فانتوم دیگر بیشتر هستند. به علت تفاوت ارتفاع قلهها، جهت به دست آوردن قله براگ پهنشده که دارای دز همواری است، قلههای مربوط به انرژیهای پایانی که دارای ارتفاع کمتری هستند دارای ضرایب وزنی بزرگترند.
در ادامه پارامترهای ارزیابی دز طبق گزارش ICRU به دست آمدند. طبق این نتایج، هرچه عمق نفوذ بیشتر باشد، شرایط درمان بهتری فراهم میآید که برای سه فانتوم تقریباً یکسان و تفاوتها ناچیز بود. شیب انتهایی دز هرچه کمتر باشد بهتر است؛ زیرا نشان میدهد دز کمتری در بافت سالم اطراف تومور تخلیه شده است که در این مورد نیز نتایج یکسان بود. نتایج مربوط به توزیع دز نشان دادند نوترونها بیشترین مقدار دز خود را در بافت سالم تخلیه میکنند و باید مورد توجه ویژه قرار گیرند؛ اگرچه برای ذرات ثانویه فوتون بیشترین مقدار دز در ناحیه تومور تخلیه میشود.
مقایسه نمودارهای مربوط به تخلیه دز عمقی نوترونها که مقدار بیشتری نسبت به فوتونها دارد نشاندهنده مشابهبودن روند نمودار برای فاتتوم تشکیلشده از مواد واقعی کبد و بافت نرم است و بیشترین مقدار کل دز در قله نسبت به نتایج فانتوم آب حدود 1/3 برابر است. در قسمت پایانی، مجموع دز ناشی از پروتون و ذرات ثانویه در تومور و 22 ارگان غیردرگیر بدن محاسبه شد.
نتیجهگیری
محاسبه دز در ارگانهای مختلف بدن نشان دادند اکثر اجزای بدن دز دریافت کردهاند و اندامهای نزدیک کبد مانند قلب، معده، پانکراس و غیره دز بیشتری نسبت به سایر اعضا دریافت کردهاند. ولی این مقدار دز در مقایسه با دز دریافتی توسط تومور بسیار ناچیز است. به گونهای که دز دریافتی در قسمت سالم کبد به نسبت یکصدم دز رسیده به تومور است و این نسبت در سایر اعضا روال کاهشی بسیار زیادی دارد. روند نمودار کاهش دز در اندامهای اطراف تومور برای سه فانتوم نیز مشابه بود و تفاوت چندانی مشاهده نشد. نتایج این پژوهش نشان میدهند استفاده از بافت نرم نتایج نزدیکتری برای جایگزینی بافت واقعی کبد در مقایسه با فانتوم آب دارد و برای کارهای دزیمتری باید سعی شود که از فانتومهای واقعیتر استفاده شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این مورد قبلا مکاتبات انجام شده است. با توجه به شبیه سازی بودن مطالعه، نیازی به کد اخلاق وجود نداشت.
حامی مالی
این مقاله از رساله دکترای نویسنده اول (زهرا احمدی گنجه) در دانشکده فیزیک، پردیس علوم پایه، دانشگاه یزد استخراج شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
ضرایب وزنی مناسب برای ایجاد قله پهنشده جهت پوشش کامل تومور برای سه فانتوم محاسبه شد که نتایج نشان داد این ضرایب برای دو فانتوم بافت نرم و کبد تقریباً یکسان و برای فانتوم آب کمی متفاوت است. در فانتوم آب ارتفاع قلهها نسبت به دو فانتوم دیگر، کمتر و ضرایب وزنی به جز در انرژی اول نسبت به دو فانتوم دیگر بیشتر هستند. به علت تفاوت ارتفاع قلهها، جهت به دست آوردن قله براگ پهنشده که دارای دز همواری است، قلههای مربوط به انرژیهای پایانی که دارای ارتفاع کمتری هستند دارای ضرایب وزنی بزرگترند.
در ادامه پارامترهای ارزیابی دز طبق گزارش ICRU به دست آمدند. طبق این نتایج، هرچه عمق نفوذ بیشتر باشد، شرایط درمان بهتری فراهم میآید که برای سه فانتوم تقریباً یکسان و تفاوتها ناچیز بود. شیب انتهایی دز هرچه کمتر باشد بهتر است؛ زیرا نشان میدهد دز کمتری در بافت سالم اطراف تومور تخلیه شده است که در این مورد نیز نتایج یکسان بود. نتایج مربوط به توزیع دز نشان دادند نوترونها بیشترین مقدار دز خود را در بافت سالم تخلیه میکنند و باید مورد توجه ویژه قرار گیرند؛ اگرچه برای ذرات ثانویه فوتون بیشترین مقدار دز در ناحیه تومور تخلیه میشود.
مقایسه نمودارهای مربوط به تخلیه دز عمقی نوترونها که مقدار بیشتری نسبت به فوتونها دارد نشاندهنده مشابهبودن روند نمودار برای فاتتوم تشکیلشده از مواد واقعی کبد و بافت نرم است و بیشترین مقدار کل دز در قله نسبت به نتایج فانتوم آب حدود 1/3 برابر است. در قسمت پایانی، مجموع دز ناشی از پروتون و ذرات ثانویه در تومور و 22 ارگان غیردرگیر بدن محاسبه شد.
نتیجهگیری
محاسبه دز در ارگانهای مختلف بدن نشان دادند اکثر اجزای بدن دز دریافت کردهاند و اندامهای نزدیک کبد مانند قلب، معده، پانکراس و غیره دز بیشتری نسبت به سایر اعضا دریافت کردهاند. ولی این مقدار دز در مقایسه با دز دریافتی توسط تومور بسیار ناچیز است. به گونهای که دز دریافتی در قسمت سالم کبد به نسبت یکصدم دز رسیده به تومور است و این نسبت در سایر اعضا روال کاهشی بسیار زیادی دارد. روند نمودار کاهش دز در اندامهای اطراف تومور برای سه فانتوم نیز مشابه بود و تفاوت چندانی مشاهده نشد. نتایج این پژوهش نشان میدهند استفاده از بافت نرم نتایج نزدیکتری برای جایگزینی بافت واقعی کبد در مقایسه با فانتوم آب دارد و برای کارهای دزیمتری باید سعی شود که از فانتومهای واقعیتر استفاده شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
در این مورد قبلا مکاتبات انجام شده است. با توجه به شبیه سازی بودن مطالعه، نیازی به کد اخلاق وجود نداشت.
حامی مالی
این مقاله از رساله دکترای نویسنده اول (زهرا احمدی گنجه) در دانشکده فیزیک، پردیس علوم پایه، دانشگاه یزد استخراج شده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتهاند.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
References
Doyen J, Falk AT, Floquet V, Herault J, Hannoun-Levi JM. Proton beams in cancer treatments: Clinical outcomes and dosimetric comparisons with photon therapy. Cancer Treat Rev. 2016; 43:104-12. [DOI:10.1016/j.ctrv.2015.12.007] [PMID]
Larsson B. Proton and heavy ion therapy. Exp Suppl. 1975; 24:414-8. [DOI:10.1007/978-3-0348-5520-4_88] [PMID]
Suit H, DeLaney T, Goldberg S, Paganetti H, Clasie B, Gerweck L, et al. Proton vs carbon ion beams in the definitive radiation treatment of cancer patients. Radiother Oncol. 2010; 95(1):3-22. [DOI:10.1016/j.radonc.2010.01.015] [PMID]
Levin WP, DeLaney TF. Chapter 19 - Charged particle radiotherapy. In: Gunderson LL, Tepper JE, editors. Clinical Radiation Oncology (Third Edition). Philadelphia: W.B. Saunders. 2012: 361-76. [DOI:10.1016/B978-1-4377-1637-5.00019-5]
Seif F, Bayatiani MR. Cancer and radiotherapy. J Arak Univ of Med Sci. 2018; 21(4):1-5.
Wilson RR. Radiological use of fast protons. Radiology. 1946; 47(5):487-91. [DOI:10.1148/47.5.487] [PMID]
Peschel RE. Notice: recently published book: proton therapy and radiosurgery, H. Breuer, B.J. Smit, springer-verlag; 2000. Int J Cancer. 2000; 90(2):112. [DOI:10.1002/(SICI)1097-0215(20000420)90:23.0.CO;2-X]
Khan FM. The physics of radiation therapy. Philadelphia: Lippincott Williams & Wilkins; 2010.
Lawrence JH, Tobias CA, Born JL, McCombs RK, Roberts JE, Anger HO, et al. Pituitary irradiation with high-energy proton beams: A preliminary report. Cancer Res. 1958; 18(2):121-34. [PMID]
Abril I, de Vera P, Garcia-Molina R, Kyriakou I, Emfietzoglou D. Lateral spread of dose distribution by therapeutic proton beams in liquid water. : Nucl Instrum Methods Phys Res B. 2015; 352:176-80. [DOI:10.1016/j.nimb.2014.11.100]
Paganetti H. Proton Beam therapy. Florida: CRC Press. 2016. [DOI:10.1088/978-0-7503-1370-4ch1]
Klodowska M, Olko P, Waligorski MP. Proton microbeam radiotherapy with scanned pencil-beams--Monte Carlo simulations. Phys Med. 2015; 31(6):621-6. [DOI:10.1016/j.ejmp.2015.04.006] [PMID]
Paganetti H. Proton Beam therapy. Florida: CRC Press. 2016. [DOI:10.1088/978-0-7503-1370-4ch1]
Bonfrate A, Farah J, De Marzi L, Delacroix S, Herault J, Sayah R, et al. Influence of beam incidence and irradiation parameters on stray neutron doses to healthy organs of pediatric patients treated for an intracranial tumor with passive scattering proton therapy. Physica Med. 2016; 32(4):590-9. [DOI:10.1016/j.ejmp.2016.03.009] [PMID]
Moteabbed M, Yock TI, Depauw N, Madden TM, Kooy HM, Paganetti H. Impact of spot size and beam-shaping devices on the treatment plan quality for pencil beam scanning proton therapy. Int J Radiat Oncol Biol Phys. 2016; 95(1):190-8. [DOI:10.1016/j.ijrobp.2015.12.368] [PMID] [PMCID]
Schneider U, Agosteo S, Pedroni E, Besserer J. Secondary neutron dose during proton therapy using spot scanning. Int J Radiat Oncol Biol Phys. 2002; 53(1):244-51. [DOI:10.1016/S0360-3016(01)02826-7]
Schneider U, Halg RA, Lomax T. Neutrons in active proton therapy: Parameterization of dose and dose equivalent. Z Med Phys. 2017; 27(2):113-23. [DOI:10.1016/j.zemedi.2016.07.001] [PMID]
Islam MR, Zheng Y, Collums TL, Monson JM, Ahmad S, Benton ER. Measurement and simulation of secondary neutrons from uniform scanning proton beams in proton radiotherapy. Radiat Meas. 2017; 96:8-18. [DOI:10.1016/j.radmeas.2016.11.008]
Agosteo S, Birattari C, Caravaggio M, Silari M, Tosi G. Secondary neutron and photon dose in proton therapy. Radiother Oncol. 1998; 48(3):293-305 [DOI:10.1016/S0167-8140(98)00049-8]
Fukumitsu N, Okumura T, Takizawa D, Makishima H, Numajiri H, Murofushi K, et al. Proton beam therapy for metastatic liver tumors. Radiother Oncol. 2015; 117(2):322-7. [DOI:10.1016/j.radonc.2015.09.011] [PMID]
Arscott WT, Thompson RF, Yin L, Burgdorf B, Kirk M, Ben-Josef E. Stereotactic body proton therapy for liver tumors: Dosimetric advantages and their radiobiological and clinical implications. Phys Imaging Radiat Oncol. 2018; 8:17-22. [DOI:10.1016/j.phro.2018.11.004]
Hong TS, DeLaney TF, Mamon HJ, Willett CG, Yeap BY, Niemierko A, et al. A prospective feasibility study of respiratory-gated proton beam therapy for liver tumors. Pract Radiat Oncol. 2014; 4(5):316-22. [DOI:10.1016/j.prro.2013.10.002] [PMID] [PMCID]
Chuong M, Kaiser A, Molitoris J, Romero AM, Apisarnthanarax S. Proton beam therapy for liver cancers. J Gastrointest Oncol. 2020; 11(1). [DOI:10.21037/jgo.2019.04.02]
Gualdrini G, Ferrari P. Handbook of anatomical models for radiation dosimetry. Radiation protection dosimetry. 2011; 143(1):125-7. [DOI:10.1093/rpd/ncq333]
Report of the task group on reference man ICRP Publication 23 (1975). Ann ICRP. 1980; 4(3-4). [DOI:10.1016/0146-6453(80)90047-0]
Snyder WS, Fisher HL Jr, Ford MR, Warner GG. Estimates of absorbed fractions for monoenergetic photon sources uniformly distributed in various organs of a heterogeneous phantom. J Nuc Med. 1969; (Suppl. 3):7-52. [PMID]
Ahmadi Ganjeh Z, Eslami-Kalantari M, Mowlavi AA. Dosimetry calculations of involved and noninvolved organs in proton therapy of liver cancer: A simulation study. Nucl Sciand Tech. 2019; 30(12):173. [DOI:10.1007/s41365-019-0698-8]
White DR, Booz J, Griffith RV, Spokas JJ, Wilson IJ. Report 44. Journal of the International Commission on Radiation Units and Measurements. 2016; 23(1). [DOI:10.1093/jicru/os23.1.Report44]
Prescribing, Recording, And Reporting Proton-Beam Therapy: Contents. J Int Comm Radiat Units Meas. 2007; 7(2). [DOI:10.1093/jicru/ndm021]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |