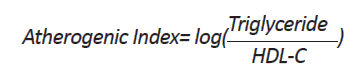BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://jams.arakmu.ac.ir/article-1-6172-fa.html
2- گروه میکروبیولوژی، دانشکده علوم پایه، دانشگاه آزاد اسلامی، واحد اراک، اراک، ایران. ،
3- گروه مهندسی مواد، دانشکده فنی و مهندسی، دانشگاه شیراز، شیراز، ایران.
4- گروه تربیت بدنی و علوم ورزشی، دانشگاه آزاد اسلامی، واحد بروجرد، بروجرد، ایران.
مقدمه
دیابت ملیتوس یکی از متداولترین بیماریهای اندوکرین با متابولیسم غیرطبیعی قند و چربی است. قند خون در مبتلایان به دیابت بهشدت افزایش می یابد و مشکلات جدی در چشم، کلیه، اعصاب و رگهای خونی ایجاد میکند [1]. بر اساس گزارش سازمان بهداشت جهانی تعداد مبتلایان به این بیماری در دنیا از 451 میلیون نفر در سال 2017 به 693 میلیون نفر تا سال 2045 افزایش خواهد یافت [2]. در سال 2016 این بیماری به طور مستقیم سبب مرگ 1/6 میلیون نفر شده و طبق تخمین سازمان بهداشت جهانی، هفتمین عامل مرگ و میر بوده است [4 ،3]. شیوع این بیماری به واسطه رژیم غذایی نامناسب، تغییر الگوی زندگی از روستایی به شهری، چاقی، استرسها و ... به خصوص در کشورهایی با درآمد متوسط و پایین، بهشدت رو به گسترش است. رژیم غذایی غربی غنی از کربوهیدارت و چربی و فقیر به لحاظ فیبر، موجب توسعه روزافزون دیابت میشود [6 ،5].
در مبتلایان به دیابت، خطر ابتلا و مرگ و میر به واسطه بیماریهای قلبی-عروقی نیز به شدت افزایش میباید. علت آن مقادیر غیر طبیعی چربی خون ناشی از سندرم متابولیک ناشی از تغییرات کمی، کیفی و حتی سنتزی لیپوپروتئینهای بدن است. غلظت پلاسمایی شیلومیکرونها، لیپوپروتئین با دانسیته کم و (LDL) لیپوپروتئین با دانسیته بسیار کم (VLDL) در افراد مبتلا به دیابت افزایش یافته و از میزان کاتابولیسم این لیپوپروتئینها کاسته میشود. از سوی دیگر، غلظت پلاسمایی لیپوپروتئینها با دانسیته بالا (HDL) کم میشود و کاتابولیسم آن نیز افزایش مییابد. افزایش میزان LDL سبب گرفتگی عروق میشود، به نحوی که خطر ابتلا به بیماری قلبی-عروقی تا 10 برابر افراد سالم افزایش مییابد [10-7].
دیابت در ارتباط مستقیم با التهاب مزمن تحت بالینی است؛ بدین معنی که سطوح غیرطبیعی از کموکاینها در بافتهای چربی دیده میشود که نتیجه آن افزایش ترشح ادیپوکاینهای پیشالتهابی است. افزایش غلظت این سایتوکاینها بهخصوص IL-6، IL-1 و TNF-α، سبب افزایش بیان پروتئین C واکنشگر در سلولهای کبدی، ماهیچه صاف و ماکروفاژها میشود [12 ،11] . این پروتئین با فعال کردن مسیر کمپلمان سبب تولید بیشتر سایتوکاینهای پیش التهابی میشود؛ ازاینرو علاوه بر اینکه یک مارکر التهاب حاد به شمار میرود، نقش مهمی در افزایش التهاب هم بازی میکند. التهاب در تمامی مراحل گرفتگی عروق، از شروع، پیشرفت و درنهایت پاره شدن رگها نقش دارد. افزایش میزان CRP و خطر ابتلا به بیماریهای قلبی-عروقی در افراد دیابتی به واسطه غیر طبیعی شدن الگوی لیپیدی است. در این افراد کاهش همزمان سطوح CRP و LDL، خطر گرفتگی رگها را به شدت کم میکند [15-13].
روش درمانی کاملی برای بیماری دیابت ارائه نشده، از این رو پیشگیری از ابتلا به این بیماری و کنترل آن حائز اهمیت فراوان است. مبتلایان به دیابت به طور معمول از مکملهای خاصی به صورت روزانه بهره می برند که از مهمترین آنها می توان به دارچین، Q10، گیاهان خانواده بامیه، منیزیم، شاه توت و سرکه اشاره کرد [16].
نقش میکروبیوتای روده در ممانعت از توسعه این بیماری، توجه بسیاری را به خود معطوف داشته است [18 ،17]. میکروبیوتای روده میتواند فیبرهای موجود در رژیم غذایی را تخمیر کرده و به اسیدهای چرب زنجیره کوتاه تبدیل کند. این اسیدها با تحریک تولید ایمنوگلوبولین A و سایتوکاینهای سرکوبگر ایمنی، نقش ضدالتهابی دارند. SCFAs سبب ترشح هورمون مشابه گلوکاگون از سلولهای انترواندوکرین میشود [20 ،19]. گلوکاگون سبب کاهش گلوکونئوژنز در کبد، افزایش حساسیت به انسولین در سلولها و افزایش احساس سیری میشود. این اسیدهای چرب به طور مستقیم مانع از التهاب خفیفی میشوند که به واسطه ورود باکتریها از روده به بافتهای چربی احشایی و خون به وجود میآید [22 ،21]. تمامی موارد فوق بیانگر اهمیت میکروبیوتا در حفظ هموستاز بدن و ممانعت از بسیاری از بیماریها ازجمله دیابت است. متأسفانه زندگی شهرنشینی به واسطه تغییر الگوی تغذیه، استفاده بیرویه از آنتیبیوتیکها، استرس و .... آسیبهایی جدی به میکروبیوتا وارد کرده که در کاهش سلامت نمود پیدا میکند. به همین دلیل است که امروزه استفاده از غذاهای عملگرا بهخصوص پروبیوتیکها به همراه گیاهان دارویی به منظور پیشگیری و کنترل دیابت در دستور کار بسیاری از کشورهای توسعه یافته قرار گرفته است.
هدف این تحقیق، تولید نسل بعدی پروبیوتیک غنیشده با عصاره گیاهی دارچین است. NGPs محصولات پروبیوتیک مؤثر روی بیماریهای خاص است که اخیراً محققان به آن توجه کردهاند. عصاره دارچین به عنوان غنیکننده انتخاب شد، زیرا طبق گزارشهای سازمان بهداشت جهانی، این گیاه متداولترین مکمل مورد استفاده در افراد دیابتی است. این گیاه دارای مواد مؤثر متفاوتی است که عوامل تقویتکننده انسولین نام دارند [24 ،23]؛ از این رو در این تحقیق، تأثیر پروبیوتیک تجاری بیوفلورا (شرکت تکژن) و عصاره آبی گیاه دارچین و اثر همافزایی ممکن آنها در کاهش قند خون، التهاب و درنتیجه کاهش خطر ابتلا به بیماریهای قلبی-عروقی در مبتلایان به دیابت بررسی شد. بیوفلورا حاوی 4 سویه بیفیدوباکتریوم بیفیدوم، بیفیدوباکتریوم لانگوم، بیفیدوباکتریوم لاکتیس و لاکتوباسیلوس اسیدوفیلوس است.
مواد و روشها
نگهداری و گروهبندی حیوانات
35 رت نر نژاد ویستار با وزن g 20±200 و سن 8 هفته از انیستیتو پاستور تهران خریداری و در حیوانخانه دانشگاه آزاد اسلامی اراک نگهداری شدند. حیوانات در دورههای روشنایی/تاریکی 12 ساعته، دمای ᵒ C 2±23 و رطوبت 50% نگهداری شدند و دسترسی آزاد به آب و غذای استاندارد (شرکت بهپرور) داشتند. تمامی مداخلات و آزمونهای انجامشده طبق قوانین اخلاق کار با حیوانات آزمایشگاهی انجام شد. پس از سازش 10 روزه، حیوانات به صورت تصادفی به 5 گروه تقسیم شدند:
کنترل منفی: رتهای سالم
کنترل مثبت: رتهای دیابتی بدون تیمار
گروه تجربی پروبیوتیک: رت دیابتی تیمار با بیوفلورا
گروه تجربی دارچین: رت دیابتی تیمار با عصاره دارچین
گروه تجربی پروبیوتیک/دارچین: رت دیابتی تیمار توأم با بیوفلورا و دارچین
القای دیابت در رتها
برای القای دیابت، دسترسی رتها به آب و غذا به مدت h 15-12 قطع شد. داروی استرپتوزوتوسین (سیگما -آلمان) به میزان mg 60 به ازای هر کیلو وزن رت، در بافر سیترات (4/5=pH) محلول و به صورت درون صفاقی تزریق شد [26 ،25]. حیوانات به مدت 1 هفته به لحاظ تغییرات رفتاری ازجمله پرنوشی و پر ادراری و کاهش وزن بررسی شدند. به منظور اطمینان از توسعه دیابت، خونگیری مستقیم از دم انجام و قند خون با استفاده از دستگاه گلوکومتر Major II Biosystem crop (ساخت تایوان) تعیین شد. رتهایی با قند بالاتر از mg/dl 300 به عنوان دیابتی در نظر گرفته شدند.
تیمار با پروبیوتیک و عصاره آبی دارچین
محتویات هر کپسول بیوفلورا شرکت تکژن (1/8 میلیارد باکتری زنده) به آب مقطر استریل افزوده و سوسپانسیون شد. روزانه ml 1 از سوسپانسیون به رتهای دریافتکننده پروبیوتیک، گاواژ درون معدی شد، به نحوی که هر رت 108×3/2 باکتری دریافت کرد. لازم به ذکر است که دوز مؤثر پروبیوتیک بر اساس تحقیقات صورت گرفته روی این محصول به هنگام انتخاب سویهها تعیین شد. گاواژ رتها به مدت 30 روز ادامه یافت.
برای تهیه عصاره آبی، نمونه دارچین (Cinnamomum Zeylanicum) از مرکز ملی ذخایر ایران تهیه و از سوی هرباریوم دانشگاه آزاد اسلامی اراک تأیید شد. دارچین با آسیاب مکانیکی پودر و ml 300 آب به هر g 100 از پودر افزوده شد. سوسپانسیون حاصل به مدت 24 ساعت در دمای اتاق هم زده و با قیف بوخنر عصارهگیری شد. محلول حاصله با استفاده از دستگاه روتاری (آلمان - IKA) تا رسیدن به حجم ml 7 تغلیظ و در دمای ᵒ C 4 نگهداری شد [22]. به هنگام استفاده، عصاره در آب مقطر رقیق شد، به نحوی که هر رت روزانه ml 1 از عصاره با غلظت mg/kg 200 را دریافت کرد [27]. به منظور بررسی همافزایی، پروبیوتیک و عصاره به غلظتهای مشابه به طور همزمان به ml 1 آب افزوده و به رتها گاواژ شد. لازم به ذکر است که به منظور یکسان سازی شرایط، رتهای گروه کنترل منفی و مثبت نیز روزانه با ml 1 آب گاواژ شدند.
آزمونهای بیوشیمیایی
در پایان دوره آزمون، دسترسی حیوانات به غذا به مدت 15 ساعت قطع شد و پس از وزنکشی با استفاده از اورتان (سیگما -آلدریچ) بیهوش و ml 5 خون به صورت مستقیم از قلب آنها گرفته شد. نمونه خون با دور rpm 3000 به مدت 10 دقیقه سانتریفیوژ و سرم جدا شده تا در دمای ᵒC 20- نگهداری شد. پروفایل لیپیدی شامل LDL، HDL، کلسترول و تریگلیسرید و قند خون با استفاده از روش رنگسنجی آنزیمی و با کیت شرکت Bionic (ایران) با استفاده از دستگاه اتوانالایزر Selectra pro XL (محصول مشترک آلمان و هلند) سنجیده شد. میزان hs-CRP سرمی با روش ایمونوتوربیدیمتریک با کیت پارس آزمون (ایران) و دستگاه Chemistry Analyzer BT 4500 (ساخت ایتالیا) اندازه گرفته شد. شاخص آتروژنی (Atherogenic Index or AI) با استفاده از فرمول زیر محاسبه شد [28]:
آنالیز آماری دادهها
دادهها با استفاده از نرم افزار Graph pad prism6 و آزمونهای T-test و واریانس یکطرفه و آزمونهای تعقیبی Tukey ارزیابی شد. نتایج حاصل به صورت میانگین و انحراف معیار گزارش و سطح معنیداری 0/05>P در نظر گرفته شد.
یافتهها
القای دیابت در رتها
القای دیابت تیپ I در رتها با تزریق 1 دوز از استرپتوزوتوسین انجام شد. پس از گذشت 7 تا 10 روز، علائم دیابت به صورت پرنوشی، پر ادراری و کاهش وزن در رتها بارز شد.
تغییرات وزنی رتها
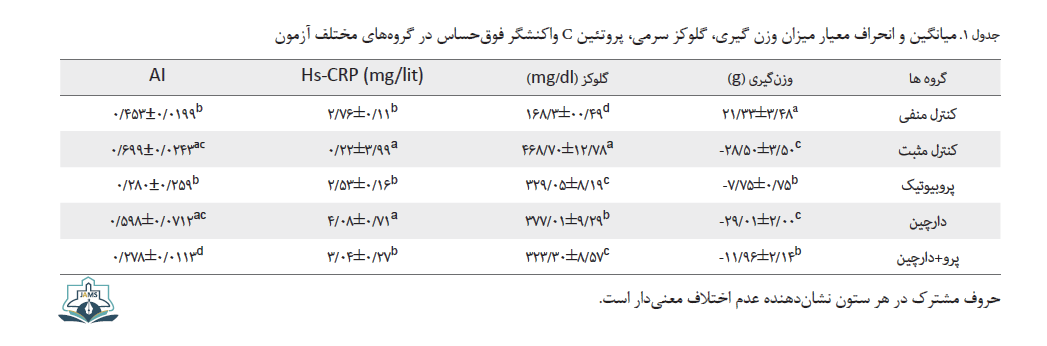
القای دیابت سبب کاهش وزن معنیدار رتها شد (جدول شماره 1).
کاهش وزن رتها در گروههای کنترل مثبت و عصاره دارچین همسان بود (P>0/9126). در گروههای دریافتکننده پروبیوتیک، کاهش وزن به شدت گروههای دیگر نبود و در حدود 73 درصد افزایش وزن رتها را نسبت به گروههای کنترل مثبت و دارچین در پی داشت ( بهترتیب 0/0013=P و 0/0011=P).
کاهش قند خون سرمی با پروبیوتیک و عصاره دارچین
قند سرمی رتها در تمامی گروهها به صورت معنیداری بیشتر از گروه کنترل منفی بود (0/0001>P) (جدول شماره 1). تیمار با پروبیوتیک و عصاره دارچین به تنهایی و به صورت توأم سبب شد که قند خون، کاهش معنیداری را نسبت به گروه کنترل مثبت نشان دهد (بهترتیب 0/0001>P و 0/0002=P). در گروههای دریافتکننده پروبیوتیک، کاهش قند خون به صورت مؤثرتری نسبت به گروه دریافتکننده عصاره دارچین دیده شد (0/0179>P)، اما سینرژی بین مصرف همزمان عصاره دارچین و پروبیوتیک در کاهش قند ملاحظه نشد.
ارزیابی الگوی لیپیدی سرم خون
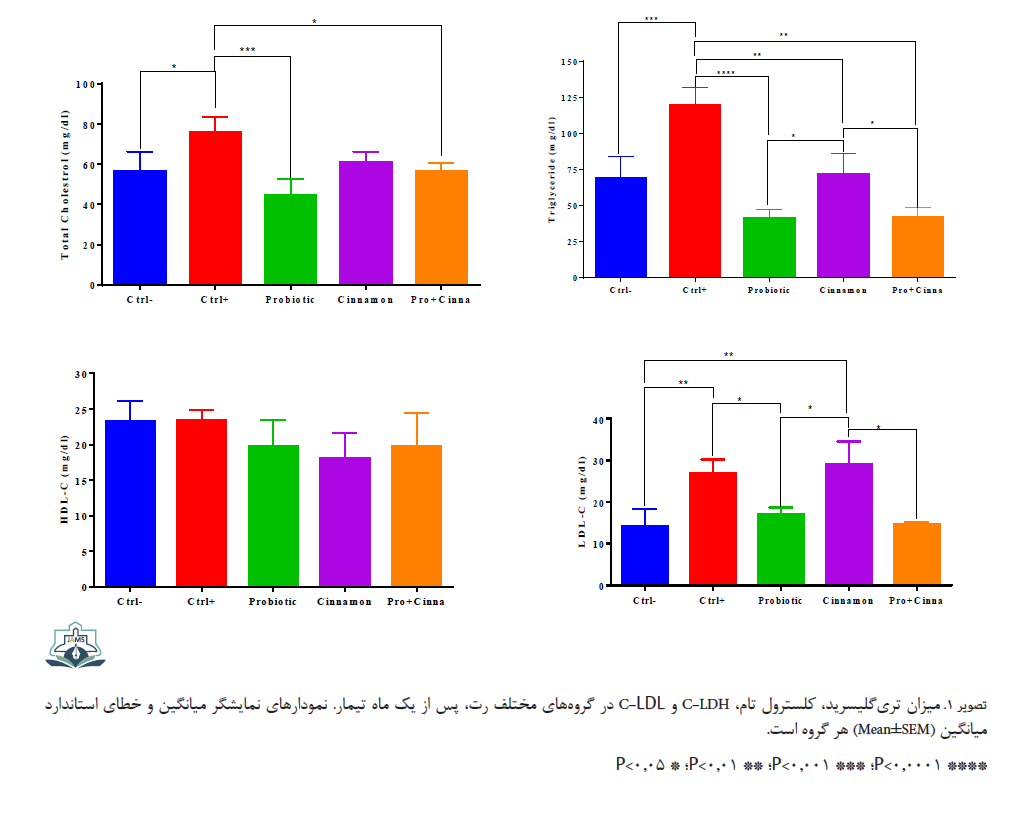
القای دیابت در رتها سبب افزایش معنیدار کلسترول و تریگلیسرید سرمی شد (تصویر شماره 1).
عصاره دارچین به صورت معنیداری سبب کاهش تریگلیسرید در رتهای دیابتی شد، درحالیکه بر سطح کلسترول تام سرمی فاقد اثر بود (بهترتیب 0/0012=P و 0/1348=P). مصرف پروبیوتیک به تنهایی یا همراه با عصاره آبی دارچین سبب شد که میزان تریگلیسرید و کلسترول تام در رتها نسبت به گروه کنترل مثبت کاهش معنیدار داشته باشد و اثر همافزایی بین پروبیوتیک و عصاره دارچین مشاهده نشد.
بررسی سطوح HDL-C نشان داد که اختلالات متابولیسمی ناشی از القای دیابت، تأثیری در سطح سرمی این فاکتور لیپیدی نداشته است (0/9417=P). تیمار پروبیوتیکی و عصاره گیاهی نیز تغییری در غلظت سرمی این فاکتور خونی ایجاد نکرد، در صورتی که میزان LDL-C به واسطه القای دیابت به صورت معنیداری در گروه کنترل مثبت افزایش یافت (0/0097=P). عصاره دارچین تأثیری در کاهش این فاکتور خونی نداشت، اما در گروههای دریافتکننده پروبیوتیک، کاهش LDL-C نسبت به گروه کنترل مثبت معنیدار بود (بهترتیب 0/0393=P و 0/0296=P). اثر همافزایی نیز در به کارگیری همزمان این دو مشاهده نشد.
در این تحقیق، شاخص آتروژنی در گروه کنترل مثبت به واسطه دیس لیپیدمی حاصله از دیابت به صورت معنیداری افزایش یافت (0/0008=P) (جدول شماره 1).
تیمار با بیوفلورا به واسطه بهبود الگوی لیپدی به صورت معنیداری، شاخص آتروژنی را بهبود بخشید، به نحوی که این شاخص حتی از گروه کنترل منفی نیز کمتر بود (0/0131=P). استفاده از دارچین تأثیری در تغییر شاخص آتروژنیک نسبت به گروه کنترل مثبت نداشت (0/2798=P).
بررسی سطوح hs-CRP
hs-CRP یکی از مهمترین شاخصهای نشاندهنده خطر ابتلا به بیماریهای قلبی و عروقی است. در این تحقیق، میزان hs-CRP سرمی به واسطه دیابت در رتهای گروه کنترل مثبت به صورت معنیداری افزایش یافت (0/0037=P) (جدول شماره 1). مصرف عصاره دارچین تأثیری در کاهش میزان این فاکتور سرمی نداشت (0/9973=P). نکته قابل توجه، تأثیر پروبیوتیک به تنهایی و به همراه دارچین در کاهش میزان این پروتئین بود، به نحوی که غلظت آن اختلاف معنیداری با گروه کنترل منفی نداشت (بهترتیب 0/9137=P و 0/8618=P).
نتیجهگیری
در این تحقیق، تأثیر پروبیوتیک BioFlora و عصاره آبی دارچین در کاهش قند خون و بهبود الگوی لیپیدی در رتهای دیابتی و درنتیجه کاهش خطر ابتلا به بیماریهای قلبی عروقی بررسی شد. نتایج حاصله از این تحقیق نشان داد که عصاره آبی دارچین سبب 19/65 درصد کاهش در میزان قند رتهای دیابتی میشود، در حالیکه در گروه پروبیوتیک این مقدار معادل 29/81 درصد است. از مهمترین ترکیبات مؤثر دارچین میتوان به سینامالدهید، سینامات، سینامیک اسید و بسیاری از روغنهای ضروری مثل اوژنول اشاره کرد. از سایر عوامل مؤثر موجود در عصاره آبی دارچین با اثر ضددیابتی میتوان پلیمرهای Procyanidin تیپ A را نام برد. این پلیمرها جذب گلوکز و سنتز گلیکوژن در کبد را افزایش و جذب گلوکز در روده کوچک را کاهش میدهند [30 ،29]. سینامتانین از دیگر ترکیبات مؤثر دارچین است که با فسفریله کردن زیرواحد از گیرنده انسولین در سلولهای ادیپوسیت سبب افزایش این گیرندهها و درنتیجه کاهش قند خون میشوند. سینامالدهید موجود در عصاره دارچین سبب میشود که بیان گیرندههای GLUT1 و GLUT4 در سلولهای ماهیچهای و ادیپوسیت افزایش یابد که سبب افزایش انتقال گلوکز به درون این سلولها میشود. به اثبات رسیده است که دارچین بیان PPAR-γ (Peroxisome proliferator-activated receptor gamma) و PPAR-α را افزایش میدهد. بیان این پروتئینها سبب افزایش حساسیت سلولها به انسولین و درنتیجه کاهش قند خون میشود. همچنین ثابت شده است که عصاره این گیاه میتواند گلوکونئوژنز را در کبد کاهش دهد و سبب تحریک فرایند سنتز گلیکوژن شود [31].
میکروارگانیسمهای پروبیوتیک نیز با مکانیسمهای چندی در کاهش قند خون مؤثر هستند که ازجمله مهمترین آنها میتوان به افزایش بیان پپتید مشابه گلوکاگون 1 (Glucagon-like peptide-1 or GLP-1)، افزایش بیان ناقلهای گلوکز در غشای سلولی و افزایش بیان PPAR-γ اشاره کرد که فاکتور رونویسی هستهای دخیل در هموستاز گلوکز است [34-32]. پروبیوتیک ها با تخمیر فیبرهای غذایی، اسیدهای چرب با زنجیره کوتاه تولید می کنند. این اسیدهای چرب منبع انرژی سلولهای روده هستند و تولید هورمونها مؤثر بر جذب و مصرف انرژی همانند لپتین و گرلین را تنظیم می کنند. اتصال اسیدهای چرب زنجیره کوتاه به گیرندههای مرتبط با پروتئین G همانند GPR41 و GPR43، بیان پپتید YY و GLP-1 را افزایش میدهد و نتیجه آن کاهش اشتها و افزایش حساسیت سلولها به انسولین است [35].
نتایج نشان داد که در شرایط به کار گرفته در این تحقیق، عصاره دارچین تأثیری بر میزان LDL-C و کلسترول تام ندارد، اما سبب کاهش میزان تریگلیسرید نسبت به گروه کنترل مثبت میشود. این عصاره با ممانعت از آنزیم HMG Co-A reductase و کاهش استرس اکسیداتیو به بهبود الگوی لیپیدی کمک میکند. همانطور که گفته شد عصاره دارچین میتواند سبب افزایش بیان PPAR-γ شود که تنظیمکننده تمایز سلولهای ادیپوسیت محسوب میشود. ثابت شده است که فعال شدن این پروتئین سبب کاهش تریگلیسرید پلاسمایی میشود و سطح HDL را نیز کاهش میدهد که این امر در نتایج حاصل از این تحقیق نیز مشاهده شد [31].
در رتهای گروه پروبیوتیک، میزان کلسترول تام، LDL-C و تریگلیسرید به صورت معنیداری کاهش یافت. آزمونهای صورتگرفته روی میکروارگانیسمهای موجود در بیوفلورا ثابت کرده است که این باکتریهایها توانایی دکونژوگه کردن نمکهای صفراوی را دارند. این امر سبب کاهش میزان لیپیدهای موجود در خون به منظور ساخت مجدد صفرا میشود. همچنین باکتریهای مذکور، توانایی تولید دامنه وسیعی از SCFAs را دارند که مانع از سنتز کلسترول در سلولهای کبدی میشود. مکانیسمهای دیگر نیز در ارتباط با توانایی کاهش سطوح لیپیدی به وسیله پروبیوتیک پیشنهاد شده است؛ ازجمله جذب کلسترول و اسمیله کردن آن در ساختار باکتریایی، اتصال لیپیدهای موجود در روده به غشای باکتری و تبدیل کلسترول به کوپروستانول. بهبود الگوی لیپیدی در نتیجه مصرف این مکمل غذایی، خطر ابتلا به گرفتگی رگ را به شدت کاهش میدهد [36]. این امر به خوبی در شاخص آتروژنیک مشاهده میشود که در گروههای دریافتکننده پروبیوتیک به وضوح کمتر از سایر گروهها حتی گروه کنترل منفی است. لازم به ذکر است که فرایند گاواژ میتواند سبب افزایش استرس در رتها شود [37]. استرس از عواملی است که سبب بالا رفتن AI شده و زمینه ساز ابتلا به بیماریهای قلبی-عروقی میشود [38].
در این تحقیق، کاهش خطر ابتلا به بیماری قلبی-عروقی با شاخص hs-CRP نیز به اثبات رسید. نتایج نشان داد که بیوفلورا، سطح hs-CRP را به صورت معنیداری کاهش می دهد، در حالی که در گروه عصاره دارچین این امر دیده نشد. hs-CRP یک متغیر غیروابسته بسیار مهم در مبتلایان به دیابت و بیماریهای قلبی و عروقی است. میزان این پروتئین هنگام ابتلا به عفونتها و بیماریهای قلبی و عروقی میتواند تا 1000 برابر افزایش یابد. این افزایش میتواند به نوبه خود به التهاب شدیدتر منجر شود. پروبیوتیکها با مهار رادیکالهای هیدروکسیل و سوپر اکسید و کاهش بیان IL-6 در ادیبوسیت ها می توانند از افزایش hs-CRP جلوگیری کنند و التهاب را کاهش دهند.
بحث
عصاره دارچین و بیوفلورا هر دو خطر ابتلا به بیماریهای قلبی-عروقی در رتهای دیابتی را کاهش میدهند که این امر با کاهش میزان قند خون، بهبود الگوی لیپیدی و کاهش hs-CRP صورت میگیرد. نتایج حاصله نشان داد که بیوفلورا کارایی بالاتری در بهبود سندرم متابولیک حاصل از این بیماری دارد و میتواند دیسلیپدمی حاصل از دیابت را بهبود بخشد. لازم به ذکر است که هیچ گونه همافزایی بین بیوفلورا و عصاره آبی دارچین در غلظتها و مدت زمان به کار گرفته شده در این تحقیق وجود ندارد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با کد اخلاق به شماره IR.IAU.ARAK.REC.1397.005 در مرکز پژوهش دانشگاه آزاد اسلامی اراک به ثبت رسیده و تمامی تداخلات صورت گرفته بر روی حیوانات مطابق دستورالعمل کار بر روی حیوانات آزمایشگاهی بوده است.
حامی مالی
این مقاله برگرفته از طرح علمی مصوب شورای پژوهشی دانشگاه آزاد اسلامی واحد اراک با مجوز 266 بوده است. بخشی از هزینه پژوهش توسط معاونت پژوهش دانشگاه مذکور تامین گردیده است.
مشارکت نویسندگان
تعریف موضوع و بیان مسئله :دکتر پروانه جعفری، فاطمه شهرستان؛ روش پژوهش: فاطمه شهرستان، آرام قره باغی، اسماعیل شهرستان آنالیز داده ها: دکتر پروانه جعفری، آرام قره باغی؛ نگارش و بازبینی: دکتر پروانه جعفری؛ اجرا: تمامی نویسندگان.
تعارض منافع
نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
تشکر و قدردانی
از معاونت پژوهشی دانشگاه آزاد اراک برای حمایت مالی این طرح و همچنین از شرکت تکژن برای تأمین پروبیوتیک بیوفلورا قدردانی میشود.
References
1.Lavin N. Manual of endocrinology and metabolism. Philadelphia, Pennsylvania, United States: Lippincott Williams & Wilkins; 2012.
2.Cho N, Shaw J, Karuranga S, Huang Y, Da Rocha Fernandes J, Ohlrogge A, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045. Diabetes Research and Clinical Practice. 2018; 138:271-81. [DOI:10.1016/j.diabres.2018.02.023] [PMID]
3.Whiting DR, Guariguata L, Weil C, Shaw JJDr, practice c. IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Research and Clinical Practice. 2011; 94(3):311-21. [DOI:10.1016/j.diabres.2011.10.029] [PMID]
4.Balakumar P, Maung UK, Jagadeesh G J P R. Prevalence and prevention of cardiovascular disease and diabetes mellitus. Pharmacological Research. 2016; 113 (Part A):600-9. [DOI:10.1016/j.phrs.2016.09.040] [PMID]
5.Pérez-Martínez P, García-Ríos A, Delgado-Lista J, Pérez-Jiménez F, López-Miranda JJ. Mediterranean diet rich in olive oil and obesity, metabolic syndrome and diabetes mellitus. Current Pharmaceutical Design. 2011; 17(8):769-77. [DOI:10.2174/138161211795428948] [PMID]
6.Guariguata L, Whiting DR, Hambleton I, Beagley J, Linnenkamp U, Shaw JEJDR, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Research and Clinical Practice. 2014; 103(2):137-49. [DOI:10.1016/j.diabres.2013.11.002] [PMID]
7.Klop B, Elte J, Cabezas MJN. Dyslipidemia in obesity: Mechanisms and potential targets. Nutrients. 2013; 5(4):1218-40. [DOI:10.3390/nu5041218] [PMID] [PMCID]
8.Wu L, Parhofer KGJM. Diabetic dyslipidemia. Diabetes Therapy. 2014; 63(12):1469-79. [DOI:10.1016/j.metabol.2014.08.010] [PMID]
9.Vergès BJD. Pathophysiology of diabetic dyslipidemia: Where are we? Diabetologia. 2015; 58(5):886-99. [DOI:10.1007/s00125-015-3525-8] [PMID] [PMCID]
10.Jaiswal M, Schinske A, Pop-Busui RJBP, Endocrinology RC, Metabolism. Lipids and lipid management in diabetes. Best Practice & Research: Clinical Endocrinology. 2014; 28(3):325-38. [DOI:10.1016/j.beem.2013.12.001] [PMID]
11.Esser N, Legrand-Poels S, Piette J, Scheen AJ, Paquot NJDR. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes. Diabetes Research and Clinical Practice. 2014; 105(2):141-50. [DOI:10.1016/j.diabres.2014.04.006] [PMID]
12.Mahluji S, Ostadrahimi A, Mobasseri M, Attari VE, Payahoo LJA. Anti-inflammatory effects of Zingiber officinale in type 2 diabetic patients. Advanced Pharmaceutical Bulletin. 2013; 3(2):273.
13.Laakso MJDc. Cardiovascular disease in type 2 diabetes from population to man to mechanisms: The Kelly West Award Lecture 2008. Diabetes Care. 2010; 33(2):442-9. [DOI:10.2337/dc09-0749] [PMID] [PMCID]
14.Lee SH, Park SA, Ko SH, Yim HW, Ahn YB, Yoon KH, et al. Insulin resistance and inflammation may have an additional role in the link between cystatin C and cardiovascular disease in type 2 diabetes mellitus patients. Metabolism. 2010; 59(2):241-6. [DOI:10.1016/j.metabol.2009.07.019] [PMID]
15.Parrinello CM, Lutsey PL, Ballantyne CM, Folsom AR, Pankow JS, Selvin EJAhJ. Six-year change in high-sensitivity C-reactive protein and risk of diabetes, cardiovascular disease, and mortality. American Heart Journal. 2015; 170(2):380-9. [DOI:10.1016/j.ahj.2015.04.017] [PMID] [PMCID]
16.Ahmadi E, Alizadeh-Navaei R, Rezai MS. Efficacy of probiotic use in acute rotavirus diarrhea in children: A systematic review and meta-analysis. Caspian Journal of Internal Medicine. 2015; 6(4):187-95.
17.Parekh PJ, Nayi VR, Johnson DA, Vinik AIJFie. The role of gut microflora and the cholinergic anti-inflammatory neuroendocrine system in diabetes mellitus. Frontiers in Endocrinology. 2016; 7:55. [DOI:10.3389/fendo.2016.00055] [PMID] [PMCID]
18.Hartstra AV, Bouter KE, Bäckhed F, Nieuwdorp M. Insights into the role of the microbiome in obesity and type 2 diabetes. Diabetes Care. 2015; 38(1):159-65. [DOI:10.2337/dc14-0769] [PMID]
19.Tolhurst G, Heffron H, Lam YS, Parker HE, Habib AM, Diakogiannaki E, et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2. Diabetes. 2012; 61(2):364-71. [DOI:10.2337/db11-1019] [PMID] [PMCID]
20.Kim CH, Park J, Kim MJIn. Gut microbiota-derived short-chain fatty acids, T cells, and inflammation. Immune Network. 2014; 14(6):277-88. [DOI:10.4110/in.2014.14.6.277] [PMID] [PMCID]
21.Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell. 2016; 165(6):1332-45. [DOI:10.1016/j.cell.2016.05.041] [PMID]
22.Blaut MJPotNS. Gut microbiota and energy balance: role in obesity. Proceedings of the Nutrition Society. 2015; 74(3):227-34. [DOI:10.1017/S0029665114001700] [PMID]
23.Qin B, Panickar KS, Anderson RA. Cinnamon: Potential role in the prevention of insulin resistance, metabolic syndrome, and type 2 diabetes. Journal of Diabetes Science and Technology. 2010; 4(3):685-93. [DOI:10.1177/193229681000400324] [PMID] [PMCID]
24.Gruenwald J, Freder J, Armbruester N. Cinnamon and health. Critical Reviews in Food Science and Nutrition. 2010; 50(9):822-34. [DOI:10.1080/10408390902773052] [PMID]
25.Babujanarthanam R, Kavitha P, Rao UM, Pandian MR. Quercitrin a bioflavonoid improves the antioxidant status in streptozotocin: Induced diabetic rat tissues. Fundamental & Clinical Pharmacology. 2011; 358(1-2):121. [DOI:10.1007/s11010-011-0927-x] [PMID]
26.Etuk EJABJA. Animals models for studying diabetes mellitus. Agriculture and Biology Journal of North America. 2010; 1(2):130-4.
27.Shokri G, Fathi H, Jafari Sabet M, Nasri Nasrabadi N, Ataee R. Evaluation of anti-diabetic effects of hydroalcoholic extract of green tea and cinnamon on streptozotocin-induced diabetic rats. 2015, 1(2):20-9. [DOI:10.18869/acadpub.pbr.1.2.20]
28.Dobiášová M, Frohlich J, Šedová M, Cheung MC, Brown BG. Cholesterol esterification and atherogenic index of plasma correlate with lipoprotein size and findings on coronary angiography. Journal of Lipid Research. 2011; 52(3):566-71. [DOI:10.1194/jlr.P011668] [PMID] [PMCID]
29.Mollazadeh H, Hosseinzadeh HJIjobms. Cinnamon effects on metabolic syndrome: a review based on its mechanisms. 2016;19(12):1258.
30.Lu Z, Jia Q, Wang R, Wu X, Wu Y, Huang C, Li Y. Hypoglycemic activities of A-and B-type procyanidin oligomer-rich extracts from different Cinnamon barks. Phytomedicine. 2011; 18(4):298-302. [DOI:10.1016/j.phymed.2010.08.008] [PMID]
31.Medagama ABJ. The glycaemic outcomes of Cinnamon, a review of the experimental evidence and clinical trials. Nutrition Journal. 2015; 14(1):108. [DOI:10.1186/s12937-015-0098-9] [PMID] [PMCID]
32.Shah NJ, Swami OC. Role of probiotics in diabetes: A review of their rationale and efficacy. 2017.
34.Mishra AK, Dubey V, Ghosh AR. Obesity: An overview of possible role (s) of gut hormones, lipid sensing and gut microbiota. Metabolism. 2016; 65(1):48-65. [DOI:10.1016/j.metabol.2015.10.008] [PMID]
35.Ebrahimi FS, Rad AH, Mosen M, Abbasalizadeh F, Tabrizi A, Khalili L Effect of L. acidophilus and B. lactis on blood glucose in women with gestational diabetes mellitus: A randomized placebo-controlled trial. Diabetology & Metabolic Syndrome. 2019; 11(1):75. [DOI:10.1186/s13098-019-0471-5] [PMID] [PMCID]
37.Brown AP, Dinger N, Levine BS. Stress produced by gavage administration in the rat. Contemporary topics in laboratory animal science/American Association for Laboratory Animal Science. 2000; 39(1):17-21.
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |