دوره 23، شماره 1 - ( فروردین و اردیبهشت 1399 )
جلد 23 شماره 1 صفحات 81-72 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Momeni F, Nakhostin A, Bayani M. Comparison of Salivary and Gingival Crevicular Fluid Periostin Levels in Chronic Periodontitis Patients and Healthy Subjects. J Arak Uni Med Sci 2020; 23 (1) :72-81
URL: http://jams.arakmu.ac.ir/article-1-6135-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6135-fa.html
مومنی فاطمه، نخستین افروز، بیانی مجتبی. بررسی مقایسهای سطح پریوستین در بزاق و مایع شیار لثهایِ افراد مبتلا به پریودنتیت مزمن و افراد سالم. مجله دانشگاه علوم پزشكي اراك. 1399; 23 (1) :72-81
فاطمه مومنی1 

 ، افروز نخستین2
، افروز نخستین2 

 ، مجتبی بیانی3
، مجتبی بیانی3 




 ، افروز نخستین2
، افروز نخستین2 

 ، مجتبی بیانی3
، مجتبی بیانی3 


1- مرکز تحقیقات دانشجویی دانشگاه علوم پزشکی اراک، اراک، ایران.
2- گروه دندانپزشکی ترمیمی و زیبایی، دانشکده دندانپزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.
3- گروه پریودانتیکس، دانشکده دندانپزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،mbayani@mail.com
2- گروه دندانپزشکی ترمیمی و زیبایی، دانشکده دندانپزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران.
3- گروه پریودانتیکس، دانشکده دندانپزشکی، دانشگاه علوم پزشکی اراک، اراک، ایران. ،
متن کامل [PDF 3442 kb]
(1365 دریافت)
| چکیده (HTML) (4603 مشاهده)
References
Kinane DF, Stathopoulou PG, Papapanou PN. Periodontal diseases. Nat Rev Dis Primers. 2017; 3:17038. [DOI:10.1038/nrdp.2017.38] [PMID]
Scannapieco FA. Periodontal inflammation: From gingivitis to systemic disease? Compend Contin Educ Dent. 2004; 25(7 Suppl. 1):16-25. [PMID]
Takayama I, Tanabe H, Nishiyama T, Ito H, Amizuka N, Li M, et al. Periostin is required for matricellular localization of CCN3 in periodontal ligament of mice. J Cell Commun Signal. 2017; 11(1):5-13. [DOI:10.1007/s12079-016-0371-5] [PMID] [PMCID]
Du J, Li M. Functions of periostin in dental tissues and its role in periodontal tissue regeneration. Adv Exp Med Biol. 2019; 1132:63-72. [DOI:10.1007/978-981-13-6657-4_7] [PMID]
Ouanouki A, Lamy S, Annabi B. Periostin, a signal transduction intermediate in TGF-β-induced EMT in U-87MG human glioblastoma cells, and its inhibition by anthocyanidins. Oncotarget. 2018; 9(31):22023. [DOI:10.18632/oncotarget.25153] [PMID] [PMCID]
Walker JT, McLeod K, Kim S, Conway SJ, Hamilton DW. Periostin as a multifunctional modulator of the wound healing response. Cell Tissue Res. 2016; 365(3):453-65. [DOI:10.1007/s00441-016-2426-6] [PMID] [PMCID]
Chomyszyn-Gajewska M. [Evaluation of chosen salivary periodontal disease markers (Polish)]. Przegl Lek. 2010; 67(3):213-6. [PMID]
Gupta S, Chhina S, Arora SA. A systematic review of biomarkers of gingival crevicular fluid: Their predictive role in diagnosis of periodontal disease status. J Oral Biol Craniofac Res. 2018; 8(2):98-104. [DOI:10.1016/j.jobcr.2018.02.002] [PMID] [PMCID]
Deo V, Bhongade ML. Pathogenesis of periodontitis: Role of cytokines in host response. Dent Today. 2010; 29(9):60-2, 64-6; quiz 68-9. [PMID]
Esfahrood ZR, Vardian ST, Yadegari Z, Adhim M, Saravi NSV. Periostin levels in saliva of patients with chronic periodontitis. J Indian Soc Periodontol. 2018; 22(1):25-7. [DOI:10.10.4103/jisp.jisp_239_17] [PMID] [PMCID]
Kumaresan D, Balasundaram A, Naik VK, Appukuttan DP. Gingival crevicular fluid periostin levels in chronic periodontitis patients following nonsurgical periodontal treatment with low-level laser therapy. Eur J Dent. 2016; 10(4):546-50. [DOI:10.4103/1305-7456.195179] [PMID] [PMCID]
Padial-Molina M, Volk S, Taut A, Giannobile W, Rios H. Periostin is down-regulated during periodontal inflammation. J Dent Res. 2012; 91(11):1078-84. [DOI:10.1177/0022034512459655] [PMID] [PMCID]
Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol. 1999; 4(1):1-6. [DOI:10.1902/annals.1999.4.1.1] [PMID]
Navazesh M. Methods for collecting saliva. Ann N Y Acad Sci. 1993; 694:72-7. [DOI:10.1111/j.1749-6632.1993.tb18343.x] [PMID]
Padial-Molina M, Volk SL, Taut AD, Giannobile WV, Rios HF. Periostin is down-regulated during periodontal inflammation. J Dent Res. 2012; 91(11):1078-84. [DOI:10.1177/0022034512459655] [PMID] [PMCID]
Kruzynska-Frejtag A, Wang J, Maeda M, Rogers R, Krug E, Hoffman S, et al. Periostin is expressed within the developing teeth at the sites of epithelial-mesenchymal interaction. Dev Dyn. 2004; 229(4):857-68. [DOI:10.1002/dvdy.10453] [PMID]
Rios H, Koushik SV, Wang H, Wang J, Zhou HM, Lindsley A, et al. Periostin null mice exhibit dwarfism, incisor enamel defects, and an early-onset periodontal disease-like phenotype. Mol Cell Biol. 2005; 25(24):11131-44. [DOI:10.1128/MCB.25.24.11131-11144.2005] [PMID] [PMCID]
Rios HF, Ma D, Xie Y, Giannobile WV, Bonewald LF, Conway SJ, et al. Periostin is essential for the integrity and function of the periodontal ligament during occlusal loading in mice. J Periodontol. 2008; 79(8):1480-90. [DOI:10.1902/jop.2008.070624] [PMID] [PMCID]
Balli U, Keles ZP, Avci B, Guler S, Cetinkaya BO, Keles GC. Assessment of periostin levels in serum and gingival crevicular fluid of patients with periodontal disease. J Periodontal Res. 2015; 50(6):707-13. [DOI:10.1111/jre.12254] [PMID]
Horiuchi K, Amizuka N, Takeshita S, Takamatsu H, Katsuura M, Ozawa H, et al. Identification and characterization of a novel protein, periostin, with restricted expression to periosteum and periodontal ligament and increased expression by transforming growth factor beta. J Bone Miner Res. 1999; 14(7):1239-49. [DOI:10.1359/jbmr.1999.14.7.1239] [PMID]
Sidhu SS, Yuan S, Innes AL, Kerr S, Woodruff PG, Hou L, et al. Roles of epithelial cell-derived periostin in TGF-beta activation, collagen production, and collagen gel elasticity in asthma. Proc Natl Acad Sci U S A. 2010; 107(32):14170-5. [DOI:10.1073/pnas.1009426107] [PMID] [PMCID]
Nakajima M, Honda T, Miyauchi S, Yamazaki K. Th2 cytokines efficiently stimulate periostin production in gingival fibroblasts but periostin does not induce an inflammatory response in gingival epithelial cells. Arch Oral Biol. 2014; 59(2):93-101. [DOI:10.1016/j.archoralbio.2013.10.004] [PMID]
متن کامل: (2340 مشاهده)
مقدمه
پریودنتیت مزمن یکی از بیماریهای التهابی است که به وسیله عوامل پریودنتال ایجاد میشود [1]. این بیماری ساختار بافت پریودنتال را تحت تأثیر قرار میدهد و باعث تخریب سلولها و ماتریکس بافت همبند، از دست رفتن اتصالات و آماس در بافتهای حمایتکننده دندان و تحلیل استخوان میشود [2].
پریوستین یک پروتئین ماتریسلولار است که به وسیله فیبروبلاستهای لیگامان پریودنتال ترشح میشود و برای حفظ یکپارچگی، استحکام و ترمیم بافت پریودنتال ضروری است [3]. نقش پریوستین در تکامل دندان بسیار کلیدی و مهم است و واسطهای برای حفظ یکپارچگی بافتهای دندانی مخصوصاً در ناحیه تماس بین بافت نرم و سخت دهان است [4]. پریوستین به وسیله فاکتور رشد بیان میشود [5]؛ همچنین وجود بیشتر پریوستین در طول بهبود زخم نشان داده شده است [6].
بررسی ترکیبات موجود در بزاق میتواند به تشخیص زودهنگام وجود بیماری پریودنتال کمک کند [7]. در برخی از مطالعات بررسی مایع شیار لثهای نیز در سنجش وجود بیماریهای پریودنتال مؤثر بوده است [8]. نشان داده شده است که میزان برخی از سایتوکینها در بزاق بیماران مبتلا به پریودنتیت مزمن افزایش مییابد [9]؛ لذا ارزیابی بزاق وهمچنین مایع شیار لثهای میتواند روشی ارزشمند برای بررسی وجود و میزان پیشرفت بیماریهای پریودنتال باشد.
برخی از مطالعات ارتباط بین شدت بیماریهای پریودنتال و سطوح پریوستین را گزارش کردهاند [12-10]؛ درصورتیکه پریوستین با ابتلا و پیشرفت پریودنتیت ارتباط داشته باشد، بررسی سطوح آن در بزاق و مایع شیار لثهای، راهی کمهزینه و دقیق برای تشخیص زودرس بیماری پریودنتیت است.
با توجه به نتایج متفاوت در خصوص ارتباط سطوح پریوستین و همچنین عدم مطالعهای که هم سطح بزاق و هم سطوح مایع شیار لثهای پریوستین را اندازهگیری کرده باشد، مطالعه حاضر با هدف بررسی و مقایسه سطح پریوستین در بزاق و در مایع شیار لثهای افراد مبتلا به پریودنتیت مزمن با افراد سالم انجام شد.
روش
حجم نمونه
این مطالعه موردشاهدی همسانشده روی۱۰۶ نفر شامل یک گروه مبتلا به پریودنتیت مزمن (۵۳ نفر) و گروه شاهد سالم از نظر ابتلا به پریودنتیت (۵۳ نفر)، پس از اخذ کد اخلاق به شماره IR.ARAKMU.REC.1397.34 از کمیته اخلاق دانشگاه علوم پزشکی اراک و پس از اخذ رضایتنامه آگاهانه کتبی و به صورت داوطلبانه از تاریخ خرداد ماه ۱۳۹۷ تا اردیبهشت ماه ۱۳۹۸ در شهر اراک انجام شد. در این پژوهش اطلاعات دموگرافیک شامل سن، شغل، سطح تحصیلات، قد، وزن، وضعیت بهداشت دهان و دندان، ابتلا به بیماریهای سیستمیک، مصرف داروهای آنتیبیوتیک، سابقه ابتلا به بیماریهای پریودنتال، وضعیت استعمال دخانیات و مشروبات الکلی برای کلیه شرکتکنندگان بررسی شد. همچنین گروه مورد و شاهد از نظر سن، جنس، وزن و BMI همسان شدند.
معیارهای ورود و خروج
از دست دادن اتصالات CAL برابر یا بیشتر از 4 میلیمتر در گروه پریودنتیت مزمن، تحلیل استخوان مشهود در کلیشههای رادیوگرافی داخل دهانی در گروه پریودنتیت مزمن، عدم دریافت درمان پریودنتال طی شش ماه گذشته و سن بین 50-30 سال از معیارهای ورود افراد مبتلا به پریودنتیت مزمن و همچنین رضایت آگاهانه و سن بین 50-30 سال از معیارهای ورود برای افراد سالم در این مطالعه بودند. معیارهای خروج نیز عبارت بودند از: ابتلا به عفونت در شش ماه گذشته، ابتلا به دیابت، مصرف سیگار، مصرف مشروبات الکلی، بارداری، بیماران با اضافه وزن و چاقی (شاخص توده بدنی بیشتر از 25)، ابتلا به سرطان، ابتلا به اختلالات تیروئیدی، مصرف داروهایی که شرایط پریودنتال را تحت تأثیر قرار میدهد و شرایط سیستمیک نیاز به پروفیلاکسی آنتیبیوتیک قبل از معاینه پریودنتال.
تشخیص پریودنتیت مزمن شدید
کلیه ارزیابیهای پارمترهای بیماریهای پریودنتال را یک پریودنتیست انجام داد. سه پارامتر پریودنتال برای هر بیمار بررسی و ثبت شد: 1. خونریزی حین پروب Bleeding on Probing (BOP): برای اندازهگیری این شاخص، پروب بهآرامی روی لثه حرکت داده و بر اساس طبقهبندی زیر اندازهگیری شد: عدم خونریزی در طول مارژین لثه {0}، نقاط خونریزی مجزا و نقطهای و قابلرؤیت {1}، خط قرمز خونریزی در طول مارژین لثه {2} و خونریزی شدید و دربرگیرنده پاپیلای بین دندانی {3}. 2. از دست دادن اتصالات کلینیکی (CAL): این مقیاس به وسیله پروب پریودنتال از عمق پاکت پریودنتال تا اتصال مینا-سمان Cemento enamel junction (CEJ) سنجیده شد. در این شاخص اندازه 2-1 میلیمتر نشاندهنده پریودنتیت خفیف، 4-3 میلیمتر نشاندهنده پریودنتیت متوسط و برابر و درنهایت، بیشتر از 4 میلیمتر نشاندهنده پریودنتیت شدید است [13]. 3. عمق پروب (Probing Pocket Depth (PPD: این شاخص بر اساس طبقهبندی پریودنتولوژی آمریکا و طبق درگیری بافت لثهای اطراف هر دندان محاسبه شد. این عمق فاصله بین سطح کرونالی لثه آزاد هر دندان و حداکثر میزان نفوذ اپیکالی نوک پروب بود.
جمعآوری نمونه مایع شیار لثهای
در بیماران مبتلا به پریودنتیت مزمن فقط یک محل برای نمونهگیری انتخاب شد، اما در شرکتکنندگان گروه شاهد برای اطمینان از جمعآوری میزان کافی از نمونه مایع شیار لثهای چندین محل برای نمونهگیری انتخاب شد. محل نمونهگیری به وسیله رول پنبه ایزوله شد و برای جمعآوری نمونه، اطراف دندانهای مورد نظر به منظور جلوگیری از آلودگی با بزاق توسط هوا خشک شد. نمونهها به وسیله کاغذهای جاذب (Periopaper, Proflow Inc., Amityville, NY, USA) استریل گرفته شد. مقدار مایع در هر کاغذ جاذب با استفاده از دستگاه کالیبره (PeriotronTM 6000 Proflow Inc., Amityville, NY, USA) اندازهگیری شد. برای نمونهگیری، این کاغذها در شیار لثه فرو برده و در جایی که با مقاومت کمی روبهرو شدیم، به مدت یک دقیقه در همان محل قرار داده شدند و پس از جذب مایع شیار لثهای کاغذ را با دقت خارج کردیم تا از آلوده شدن با بزاق یا خون جلوگیری شود. در مواردی که کاغذ با بزاق یا خون آلوده میشد، آنها را دور انداخته و دوباره نمونهگیری را انجام دادیم. در مرحله بعد، نوارهای جاذب در لولههای حاوی محلول بافر قرار داده و در دمای منفی 20 درجه سانتیگراد نگهداری شدند. مقادیر پریوستین موجود در مایع شیار لثهای با استفاده از تست الایزا سنجیده شد.
جمعآوری نمونه بزاق
نمونه بزاق با استفاده از روش تف کردن بزاق توسط بیمار در لوله اپندورف (Eppendrof 022364111 Flex-Tube) جمعآوری شد. در این روش [14] (Navazesh method) از افراد خواسته شد که بزاق را در دهان خود جمع کنند، سپس آن را هر 60 ثانیه درون یک ظرف تف کنند، سپس این نمونهها در دمای زیر 20 درجه سانتیگراد تا زمان ارزیابی نگهداری شدند. مقادیر پریوستین موجود در بزاق با استفاده از تست الایزا سنجیده شد.
تجزیه و تحلیل آماری
برای بررسی توزیع فراوانی از آزمونهای توصیفی نظیر میانگین، انحراف معیار، فراوانی و درصد و برای بررسی نرمال بودن توزیع نمونههای مورد مطالعه از آزمون کولموگروف اسمیرنوف (Kolmogorov Smirnov) استفاده شد. برای بررسی اختلاف میانگین سطوح پریوستین در دو گروه و همچنین برای مقایسه میانگین سطوح پریوستین بر اساس پارامترهای پریودنتال از آزمون t مستقل استفاده شد. کلیه تجزیه و تحلیلها در سطح اطمینان 95 درصد و با استفاده از نرمافزار آماری stata V. 11 انجام شد.
نتایج
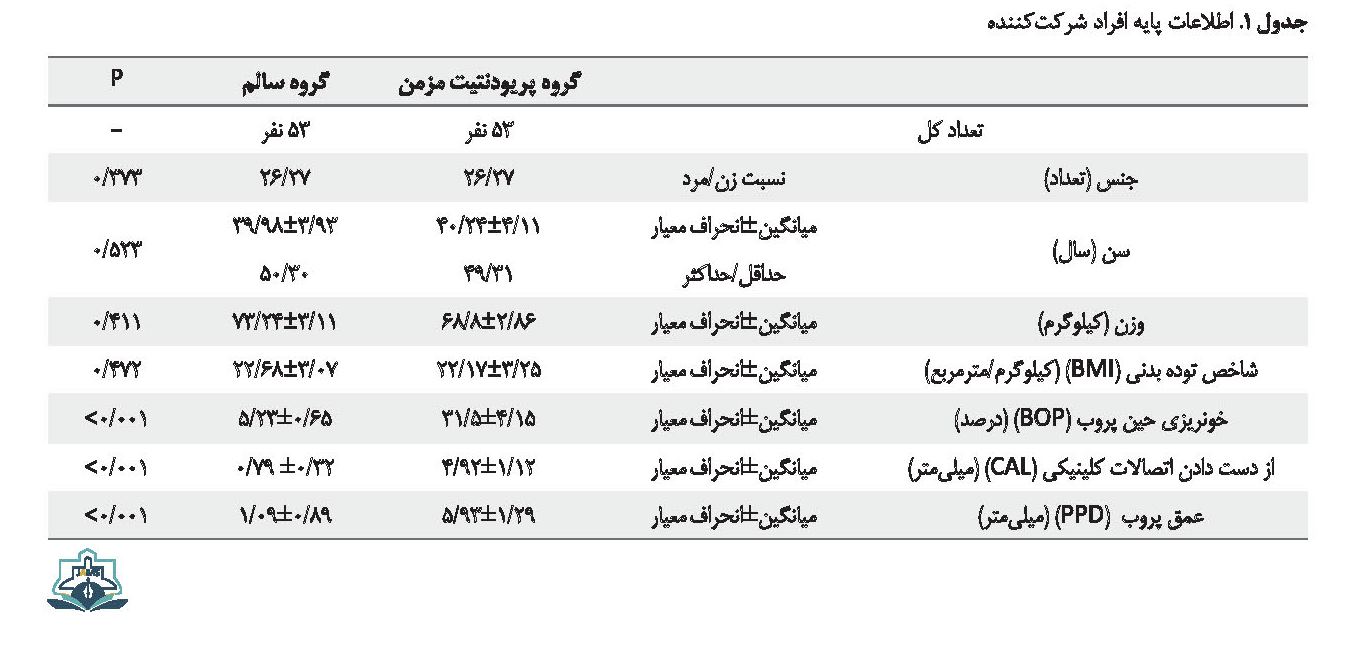
نتایج آزمون کولموگروف اسمیرنوف برای سنجش نرمال بودن توزیع نمونههای مورد مطالعه از نظر آماری معنیدار نبود که نشاندهنده نرمال بودن اطلاعات است. اطلاعات پایه و مشخصات دموگرافیک افراد شرکتکننده در هر دو گروه در جدول شماره 1 نشان داده شده است. بر اساس این جدول و با توجه به اینکه متغیرها بین دو گروه همسان شدهاند، توزیع فراوانی سن، جنس، وزن و شاخص توده بدنی در هر دو گروه یکسان است و تفاوت معنیداری بین دو گروه وجود ندارد. نتایج وضعیت شاخصهای پریودنتیت در دو گروه نیز در این جدول نشان داده شده است. بر اساس این نتایج بین دو گروه تفاوت معنیداری از نظر شاخصهای خونریزی حین پروب، از دست رفتن اتصالات کلینیکی و عمق پروب وجود دارد (0/001>P).
پریودنتیت مزمن یکی از بیماریهای التهابی است که به وسیله عوامل پریودنتال ایجاد میشود [1]. این بیماری ساختار بافت پریودنتال را تحت تأثیر قرار میدهد و باعث تخریب سلولها و ماتریکس بافت همبند، از دست رفتن اتصالات و آماس در بافتهای حمایتکننده دندان و تحلیل استخوان میشود [2].
پریوستین یک پروتئین ماتریسلولار است که به وسیله فیبروبلاستهای لیگامان پریودنتال ترشح میشود و برای حفظ یکپارچگی، استحکام و ترمیم بافت پریودنتال ضروری است [3]. نقش پریوستین در تکامل دندان بسیار کلیدی و مهم است و واسطهای برای حفظ یکپارچگی بافتهای دندانی مخصوصاً در ناحیه تماس بین بافت نرم و سخت دهان است [4]. پریوستین به وسیله فاکتور رشد بیان میشود [5]؛ همچنین وجود بیشتر پریوستین در طول بهبود زخم نشان داده شده است [6].
بررسی ترکیبات موجود در بزاق میتواند به تشخیص زودهنگام وجود بیماری پریودنتال کمک کند [7]. در برخی از مطالعات بررسی مایع شیار لثهای نیز در سنجش وجود بیماریهای پریودنتال مؤثر بوده است [8]. نشان داده شده است که میزان برخی از سایتوکینها در بزاق بیماران مبتلا به پریودنتیت مزمن افزایش مییابد [9]؛ لذا ارزیابی بزاق وهمچنین مایع شیار لثهای میتواند روشی ارزشمند برای بررسی وجود و میزان پیشرفت بیماریهای پریودنتال باشد.
برخی از مطالعات ارتباط بین شدت بیماریهای پریودنتال و سطوح پریوستین را گزارش کردهاند [12-10]؛ درصورتیکه پریوستین با ابتلا و پیشرفت پریودنتیت ارتباط داشته باشد، بررسی سطوح آن در بزاق و مایع شیار لثهای، راهی کمهزینه و دقیق برای تشخیص زودرس بیماری پریودنتیت است.
با توجه به نتایج متفاوت در خصوص ارتباط سطوح پریوستین و همچنین عدم مطالعهای که هم سطح بزاق و هم سطوح مایع شیار لثهای پریوستین را اندازهگیری کرده باشد، مطالعه حاضر با هدف بررسی و مقایسه سطح پریوستین در بزاق و در مایع شیار لثهای افراد مبتلا به پریودنتیت مزمن با افراد سالم انجام شد.
روش
حجم نمونه
این مطالعه موردشاهدی همسانشده روی۱۰۶ نفر شامل یک گروه مبتلا به پریودنتیت مزمن (۵۳ نفر) و گروه شاهد سالم از نظر ابتلا به پریودنتیت (۵۳ نفر)، پس از اخذ کد اخلاق به شماره IR.ARAKMU.REC.1397.34 از کمیته اخلاق دانشگاه علوم پزشکی اراک و پس از اخذ رضایتنامه آگاهانه کتبی و به صورت داوطلبانه از تاریخ خرداد ماه ۱۳۹۷ تا اردیبهشت ماه ۱۳۹۸ در شهر اراک انجام شد. در این پژوهش اطلاعات دموگرافیک شامل سن، شغل، سطح تحصیلات، قد، وزن، وضعیت بهداشت دهان و دندان، ابتلا به بیماریهای سیستمیک، مصرف داروهای آنتیبیوتیک، سابقه ابتلا به بیماریهای پریودنتال، وضعیت استعمال دخانیات و مشروبات الکلی برای کلیه شرکتکنندگان بررسی شد. همچنین گروه مورد و شاهد از نظر سن، جنس، وزن و BMI همسان شدند.
معیارهای ورود و خروج
از دست دادن اتصالات CAL برابر یا بیشتر از 4 میلیمتر در گروه پریودنتیت مزمن، تحلیل استخوان مشهود در کلیشههای رادیوگرافی داخل دهانی در گروه پریودنتیت مزمن، عدم دریافت درمان پریودنتال طی شش ماه گذشته و سن بین 50-30 سال از معیارهای ورود افراد مبتلا به پریودنتیت مزمن و همچنین رضایت آگاهانه و سن بین 50-30 سال از معیارهای ورود برای افراد سالم در این مطالعه بودند. معیارهای خروج نیز عبارت بودند از: ابتلا به عفونت در شش ماه گذشته، ابتلا به دیابت، مصرف سیگار، مصرف مشروبات الکلی، بارداری، بیماران با اضافه وزن و چاقی (شاخص توده بدنی بیشتر از 25)، ابتلا به سرطان، ابتلا به اختلالات تیروئیدی، مصرف داروهایی که شرایط پریودنتال را تحت تأثیر قرار میدهد و شرایط سیستمیک نیاز به پروفیلاکسی آنتیبیوتیک قبل از معاینه پریودنتال.
تشخیص پریودنتیت مزمن شدید
کلیه ارزیابیهای پارمترهای بیماریهای پریودنتال را یک پریودنتیست انجام داد. سه پارامتر پریودنتال برای هر بیمار بررسی و ثبت شد: 1. خونریزی حین پروب Bleeding on Probing (BOP): برای اندازهگیری این شاخص، پروب بهآرامی روی لثه حرکت داده و بر اساس طبقهبندی زیر اندازهگیری شد: عدم خونریزی در طول مارژین لثه {0}، نقاط خونریزی مجزا و نقطهای و قابلرؤیت {1}، خط قرمز خونریزی در طول مارژین لثه {2} و خونریزی شدید و دربرگیرنده پاپیلای بین دندانی {3}. 2. از دست دادن اتصالات کلینیکی (CAL): این مقیاس به وسیله پروب پریودنتال از عمق پاکت پریودنتال تا اتصال مینا-سمان Cemento enamel junction (CEJ) سنجیده شد. در این شاخص اندازه 2-1 میلیمتر نشاندهنده پریودنتیت خفیف، 4-3 میلیمتر نشاندهنده پریودنتیت متوسط و برابر و درنهایت، بیشتر از 4 میلیمتر نشاندهنده پریودنتیت شدید است [13]. 3. عمق پروب (Probing Pocket Depth (PPD: این شاخص بر اساس طبقهبندی پریودنتولوژی آمریکا و طبق درگیری بافت لثهای اطراف هر دندان محاسبه شد. این عمق فاصله بین سطح کرونالی لثه آزاد هر دندان و حداکثر میزان نفوذ اپیکالی نوک پروب بود.
جمعآوری نمونه مایع شیار لثهای
در بیماران مبتلا به پریودنتیت مزمن فقط یک محل برای نمونهگیری انتخاب شد، اما در شرکتکنندگان گروه شاهد برای اطمینان از جمعآوری میزان کافی از نمونه مایع شیار لثهای چندین محل برای نمونهگیری انتخاب شد. محل نمونهگیری به وسیله رول پنبه ایزوله شد و برای جمعآوری نمونه، اطراف دندانهای مورد نظر به منظور جلوگیری از آلودگی با بزاق توسط هوا خشک شد. نمونهها به وسیله کاغذهای جاذب (Periopaper, Proflow Inc., Amityville, NY, USA) استریل گرفته شد. مقدار مایع در هر کاغذ جاذب با استفاده از دستگاه کالیبره (PeriotronTM 6000 Proflow Inc., Amityville, NY, USA) اندازهگیری شد. برای نمونهگیری، این کاغذها در شیار لثه فرو برده و در جایی که با مقاومت کمی روبهرو شدیم، به مدت یک دقیقه در همان محل قرار داده شدند و پس از جذب مایع شیار لثهای کاغذ را با دقت خارج کردیم تا از آلوده شدن با بزاق یا خون جلوگیری شود. در مواردی که کاغذ با بزاق یا خون آلوده میشد، آنها را دور انداخته و دوباره نمونهگیری را انجام دادیم. در مرحله بعد، نوارهای جاذب در لولههای حاوی محلول بافر قرار داده و در دمای منفی 20 درجه سانتیگراد نگهداری شدند. مقادیر پریوستین موجود در مایع شیار لثهای با استفاده از تست الایزا سنجیده شد.
جمعآوری نمونه بزاق
نمونه بزاق با استفاده از روش تف کردن بزاق توسط بیمار در لوله اپندورف (Eppendrof 022364111 Flex-Tube) جمعآوری شد. در این روش [14] (Navazesh method) از افراد خواسته شد که بزاق را در دهان خود جمع کنند، سپس آن را هر 60 ثانیه درون یک ظرف تف کنند، سپس این نمونهها در دمای زیر 20 درجه سانتیگراد تا زمان ارزیابی نگهداری شدند. مقادیر پریوستین موجود در بزاق با استفاده از تست الایزا سنجیده شد.
تجزیه و تحلیل آماری
برای بررسی توزیع فراوانی از آزمونهای توصیفی نظیر میانگین، انحراف معیار، فراوانی و درصد و برای بررسی نرمال بودن توزیع نمونههای مورد مطالعه از آزمون کولموگروف اسمیرنوف (Kolmogorov Smirnov) استفاده شد. برای بررسی اختلاف میانگین سطوح پریوستین در دو گروه و همچنین برای مقایسه میانگین سطوح پریوستین بر اساس پارامترهای پریودنتال از آزمون t مستقل استفاده شد. کلیه تجزیه و تحلیلها در سطح اطمینان 95 درصد و با استفاده از نرمافزار آماری stata V. 11 انجام شد.
نتایج
نتایج آزمون کولموگروف اسمیرنوف برای سنجش نرمال بودن توزیع نمونههای مورد مطالعه از نظر آماری معنیدار نبود که نشاندهنده نرمال بودن اطلاعات است. اطلاعات پایه و مشخصات دموگرافیک افراد شرکتکننده در هر دو گروه در جدول شماره 1 نشان داده شده است. بر اساس این جدول و با توجه به اینکه متغیرها بین دو گروه همسان شدهاند، توزیع فراوانی سن، جنس، وزن و شاخص توده بدنی در هر دو گروه یکسان است و تفاوت معنیداری بین دو گروه وجود ندارد. نتایج وضعیت شاخصهای پریودنتیت در دو گروه نیز در این جدول نشان داده شده است. بر اساس این نتایج بین دو گروه تفاوت معنیداری از نظر شاخصهای خونریزی حین پروب، از دست رفتن اتصالات کلینیکی و عمق پروب وجود دارد (0/001>P).
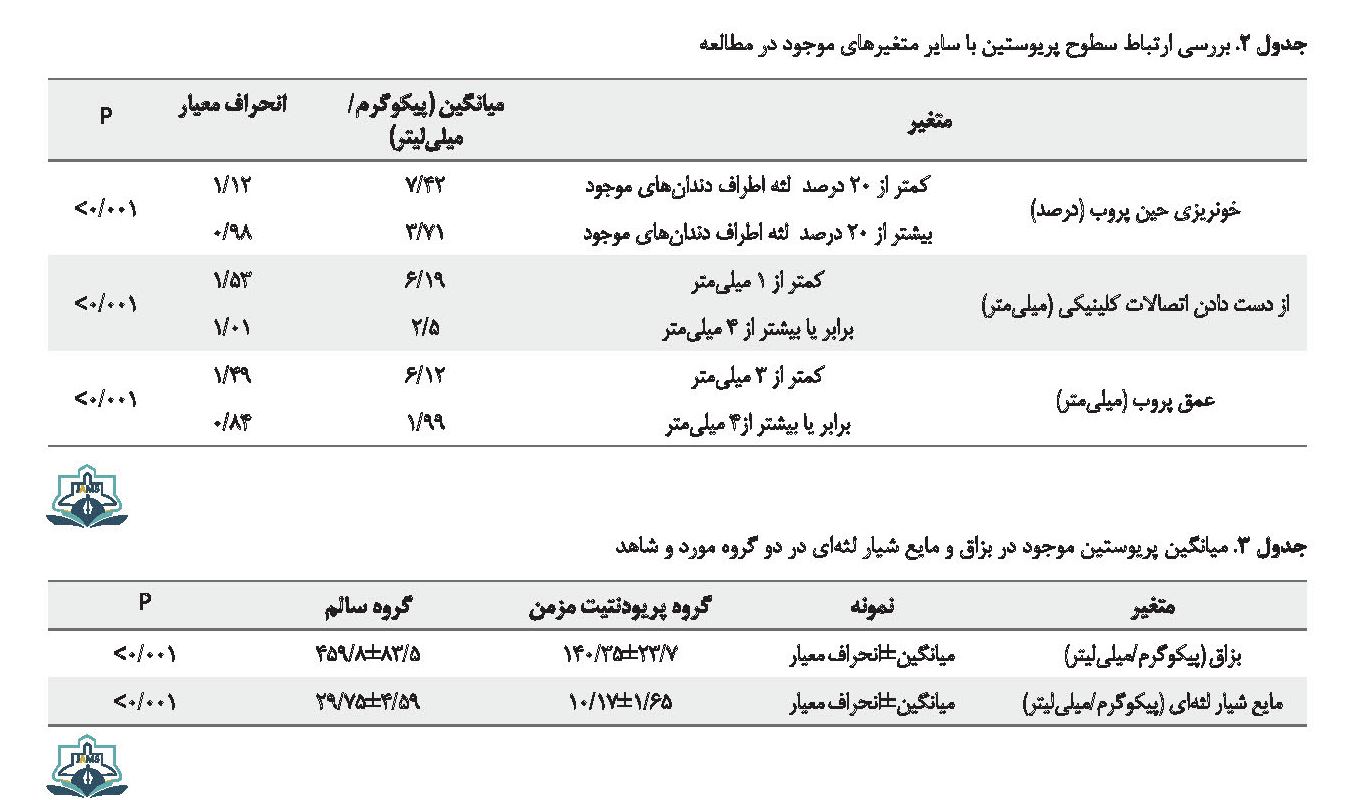
نتایج میانگین پریوستین به تفکیک شاخصهای پریودنتال در جدول شماره 2 نشان داده شده است. بر اساس نتایج این جدول سطوح پریوستین در خونریزی حین پروب کمتر از 20 درصد نسبت به خونریزی حین پروب بیشتر از 20 درصد، در از دست دادن اتصالات کلینیکی کمتر از۱ میلیمتر نسبت به از دست دادن اتصالات کلینیکی برابر یا بیشتر از 4 میلیمتر و در عمق پروب کمتر از 5 میلیمتر نسبت به عمق پروب بیشتر از 5 میلیمتر به طور معنیداری (0/001>P) بیشتر است.
نتایج میانگین سطوح پریوستین در نمونه بزاق و مایع شیار لثهای بر حسب گروه پریودنتیت مزمن و گروه سالم در جدول شماره 3 نشان داده شده است. بر اساس نتایج این جدول تفاوت معنیداری بین میزان مقادیر پریوستین موجود در نمونه بزاق و نمونه مایع شیار لثهای بین افراد شرکتکننده در گروه پریودنتیت مرمن و گروه سالم وجود دارد (0/001>P).
نتایج میانگین سطوح پریوستین در نمونه بزاق و مایع شیار لثهای بر حسب گروه پریودنتیت مزمن و گروه سالم در جدول شماره 3 نشان داده شده است. بر اساس نتایج این جدول تفاوت معنیداری بین میزان مقادیر پریوستین موجود در نمونه بزاق و نمونه مایع شیار لثهای بین افراد شرکتکننده در گروه پریودنتیت مرمن و گروه سالم وجود دارد (0/001>P).
بحث
پریوستین پروتئینی ضروری در رشد و تکامل بافتهای مختلف بدن است. اعتقاد بر این است که پریوستین نقشی کلیدی در بههمپیوستگی ساختاری بافتهای بدن ازجلمه لیگامان پریودنتال دارد [12]. مطالعه حاضر به طور همزمان به مقایسه سطوح پریوستین موجود در مایع شیار لثهای و بزاق در افراد مبتلا به بیماری پریودنتیت مزمن در مقایسه با گروه سالم پرداخته است.
پریوستین نقشی کلیدی در تکامل بافتهای حمایتکننده دندان دارد [17-15]. در مطالعهای که Balli و همکاران انجام دادهاند، سطوح سرمی و مایع شیار لثهای پریوستین در بیماران مبتلا به پریودنتیت به طور معنیداری پایینتر از گروه سالم بود که نتایج مایع شیار لثهای این مطالعه با نتایج مطالعه ما همسوست [18]. همچنین در مطالعهای که رضایی و همکاران انجام دادهاند، سطوح پریوستین بزاق در گروه بیماران مبتلا به پریودنتیت کمتر از افراد سالم بود که موافق با یافتههای نتایج بزاق مطالعه حاضر است [10]. پریوستین به عنوان پروتئینی چندسلولی به طور معمول در ساختار لیگامان پریودنتال دیده میشود [19].
TGF-β1 رهاسازی پریوستین را در فیبروبلاستهای لثهای انسان تحریک میکند، درصورتیکه Tumor Necrosis Factor -α این پروسه را مهار میکند. اینترلوکین 13 و 14از عوامل مهم دیگر در تنظیم پریوستین در لثه و فیبروبلاستهای لیگامان پریودنتال هستند. مقادیر این دو سایتوکین در حضور بیماریهای پریودنتال افزایش مییابد [20]. البته در مطالعات مشخص شده است که لیپوپلیساکارید حاصل از باکتریهای عامل ایجاد عفونت لثه تأثیری بر سطوح پریوستین ندارد [21]. کاهش سطح پریوستین در بیماران مبتلا به پریودنتیت میتواند به دو دلیل باشد: اولین دلیل وجود باکتری است. رقابت باکتریها علت کاهش سطوح پریوستین تولیدشده توسط فیبروبلاستهای لیگامان پریودنتال است. دومین دلیل کاهش تعداد فیبروبلاستهای لیگامان پریودنتال در خلال بیماریهای لثه است که ساخت و ترشح پریوستین در بافتهای حمایتکننده دندان را کاهش میدهد. کاهش سطوح پریوستین یکی از عوامل ایجاد التهاب و افزایش آسیب در ساختار لیگامان پریودنتال است [17 ،16].
در مطالعه حاضر سطوح پریوستین هم در بزاق و هم در مایع شیار لثهای در افراد مبتلا به پریودنتیت مزمن پایینتر از افراد گروه سالم بود. پریوستین ممکن است بتواند به عنوان یک بیومارکر احتمالی برای تشخیص بیماریهای پریودنتال عمل کند. پیشنهاد میشود مطالعات بیشتری برای ارزیابی کارایی این بیومارکر در تشخیص زودرس بیماریهای پریودنتال و پیشگیری از پیشرفت آن انجام شود. ازجمله محدودیتهای مطالعه حاضر این است که تغییرات سطح پریوستین را بعد از درمان مناسب پریودنتیت مزمن اندازهگیری نکرد و نویسندگان پیشنهاد میکنند که این موضوع در مطالعات آینده بررسی شود. محدودیت دیگر این مطالعه عدم اندازهگیری سطح پریوستین موجود در سرم بود. با توجه به این محدودیتها پیشنهاد میشود مطالعاتی با حجم نمونه بیشتر و به صورت مداخلهای، سطح پریوستین را قبل و بعد از درمان پریودنتیت مزمن اندازهگیری و مقایسه کنند.
نتیجهگیری
با وجود این محدودیتها نتایج مطالعه حاضر گواه خوبی برای کاهش سطوح پریوستین بزاق و مایع شیار لثهای در بیماری پریودنتیت مزمن نسبت به افراد سالم بود؛ بنابراین با توجه به نتایج این مطالعه، پریوستین میتواند به عنوان یک مارکر التهابی مناسب برای تشخیص زودرس پریودنتیت مزمن و پیشگیری از پیشرفت آن در نظر گرفته شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله حاصل از نتایج پایان نامه دوره دندانپزشک عمومی مصوب شورای پژوهشی دانشگاه علوم پزشکی اراک با کد اخلاق IR.ARAKMU.REC.1397.34 است.
حامی مالی
معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی اراک تأمین مالی این پروژه را بر عهده داشته است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی را بر اساس پیشنهادات کمیته بینالمللی ناشران مجلات پزشکی دارا بودند.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
تشکر و قدردانی
این مطالعه هیچگونه حامی مالی نداشته است. بدینوسیله از همکاریهای دانشگاه علوم پزشکی اراک در انجام این پژوهش تشکر و قدردانی میشود.
پریوستین پروتئینی ضروری در رشد و تکامل بافتهای مختلف بدن است. اعتقاد بر این است که پریوستین نقشی کلیدی در بههمپیوستگی ساختاری بافتهای بدن ازجلمه لیگامان پریودنتال دارد [12]. مطالعه حاضر به طور همزمان به مقایسه سطوح پریوستین موجود در مایع شیار لثهای و بزاق در افراد مبتلا به بیماری پریودنتیت مزمن در مقایسه با گروه سالم پرداخته است.
پریوستین نقشی کلیدی در تکامل بافتهای حمایتکننده دندان دارد [17-15]. در مطالعهای که Balli و همکاران انجام دادهاند، سطوح سرمی و مایع شیار لثهای پریوستین در بیماران مبتلا به پریودنتیت به طور معنیداری پایینتر از گروه سالم بود که نتایج مایع شیار لثهای این مطالعه با نتایج مطالعه ما همسوست [18]. همچنین در مطالعهای که رضایی و همکاران انجام دادهاند، سطوح پریوستین بزاق در گروه بیماران مبتلا به پریودنتیت کمتر از افراد سالم بود که موافق با یافتههای نتایج بزاق مطالعه حاضر است [10]. پریوستین به عنوان پروتئینی چندسلولی به طور معمول در ساختار لیگامان پریودنتال دیده میشود [19].
TGF-β1 رهاسازی پریوستین را در فیبروبلاستهای لثهای انسان تحریک میکند، درصورتیکه Tumor Necrosis Factor -α این پروسه را مهار میکند. اینترلوکین 13 و 14از عوامل مهم دیگر در تنظیم پریوستین در لثه و فیبروبلاستهای لیگامان پریودنتال هستند. مقادیر این دو سایتوکین در حضور بیماریهای پریودنتال افزایش مییابد [20]. البته در مطالعات مشخص شده است که لیپوپلیساکارید حاصل از باکتریهای عامل ایجاد عفونت لثه تأثیری بر سطوح پریوستین ندارد [21]. کاهش سطح پریوستین در بیماران مبتلا به پریودنتیت میتواند به دو دلیل باشد: اولین دلیل وجود باکتری است. رقابت باکتریها علت کاهش سطوح پریوستین تولیدشده توسط فیبروبلاستهای لیگامان پریودنتال است. دومین دلیل کاهش تعداد فیبروبلاستهای لیگامان پریودنتال در خلال بیماریهای لثه است که ساخت و ترشح پریوستین در بافتهای حمایتکننده دندان را کاهش میدهد. کاهش سطوح پریوستین یکی از عوامل ایجاد التهاب و افزایش آسیب در ساختار لیگامان پریودنتال است [17 ،16].
در مطالعه حاضر سطوح پریوستین هم در بزاق و هم در مایع شیار لثهای در افراد مبتلا به پریودنتیت مزمن پایینتر از افراد گروه سالم بود. پریوستین ممکن است بتواند به عنوان یک بیومارکر احتمالی برای تشخیص بیماریهای پریودنتال عمل کند. پیشنهاد میشود مطالعات بیشتری برای ارزیابی کارایی این بیومارکر در تشخیص زودرس بیماریهای پریودنتال و پیشگیری از پیشرفت آن انجام شود. ازجمله محدودیتهای مطالعه حاضر این است که تغییرات سطح پریوستین را بعد از درمان مناسب پریودنتیت مزمن اندازهگیری نکرد و نویسندگان پیشنهاد میکنند که این موضوع در مطالعات آینده بررسی شود. محدودیت دیگر این مطالعه عدم اندازهگیری سطح پریوستین موجود در سرم بود. با توجه به این محدودیتها پیشنهاد میشود مطالعاتی با حجم نمونه بیشتر و به صورت مداخلهای، سطح پریوستین را قبل و بعد از درمان پریودنتیت مزمن اندازهگیری و مقایسه کنند.
نتیجهگیری
با وجود این محدودیتها نتایج مطالعه حاضر گواه خوبی برای کاهش سطوح پریوستین بزاق و مایع شیار لثهای در بیماری پریودنتیت مزمن نسبت به افراد سالم بود؛ بنابراین با توجه به نتایج این مطالعه، پریوستین میتواند به عنوان یک مارکر التهابی مناسب برای تشخیص زودرس پریودنتیت مزمن و پیشگیری از پیشرفت آن در نظر گرفته شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله حاصل از نتایج پایان نامه دوره دندانپزشک عمومی مصوب شورای پژوهشی دانشگاه علوم پزشکی اراک با کد اخلاق IR.ARAKMU.REC.1397.34 است.
حامی مالی
معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی اراک تأمین مالی این پروژه را بر عهده داشته است.
مشارکت نویسندگان
تمامی نویسندگان معیارهای استاندارد نویسندگی را بر اساس پیشنهادات کمیته بینالمللی ناشران مجلات پزشکی دارا بودند.
تعارض منافع
بدینوسیله نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
تشکر و قدردانی
این مطالعه هیچگونه حامی مالی نداشته است. بدینوسیله از همکاریهای دانشگاه علوم پزشکی اراک در انجام این پژوهش تشکر و قدردانی میشود.
References
Kinane DF, Stathopoulou PG, Papapanou PN. Periodontal diseases. Nat Rev Dis Primers. 2017; 3:17038. [DOI:10.1038/nrdp.2017.38] [PMID]
Scannapieco FA. Periodontal inflammation: From gingivitis to systemic disease? Compend Contin Educ Dent. 2004; 25(7 Suppl. 1):16-25. [PMID]
Takayama I, Tanabe H, Nishiyama T, Ito H, Amizuka N, Li M, et al. Periostin is required for matricellular localization of CCN3 in periodontal ligament of mice. J Cell Commun Signal. 2017; 11(1):5-13. [DOI:10.1007/s12079-016-0371-5] [PMID] [PMCID]
Du J, Li M. Functions of periostin in dental tissues and its role in periodontal tissue regeneration. Adv Exp Med Biol. 2019; 1132:63-72. [DOI:10.1007/978-981-13-6657-4_7] [PMID]
Ouanouki A, Lamy S, Annabi B. Periostin, a signal transduction intermediate in TGF-β-induced EMT in U-87MG human glioblastoma cells, and its inhibition by anthocyanidins. Oncotarget. 2018; 9(31):22023. [DOI:10.18632/oncotarget.25153] [PMID] [PMCID]
Walker JT, McLeod K, Kim S, Conway SJ, Hamilton DW. Periostin as a multifunctional modulator of the wound healing response. Cell Tissue Res. 2016; 365(3):453-65. [DOI:10.1007/s00441-016-2426-6] [PMID] [PMCID]
Chomyszyn-Gajewska M. [Evaluation of chosen salivary periodontal disease markers (Polish)]. Przegl Lek. 2010; 67(3):213-6. [PMID]
Gupta S, Chhina S, Arora SA. A systematic review of biomarkers of gingival crevicular fluid: Their predictive role in diagnosis of periodontal disease status. J Oral Biol Craniofac Res. 2018; 8(2):98-104. [DOI:10.1016/j.jobcr.2018.02.002] [PMID] [PMCID]
Deo V, Bhongade ML. Pathogenesis of periodontitis: Role of cytokines in host response. Dent Today. 2010; 29(9):60-2, 64-6; quiz 68-9. [PMID]
Esfahrood ZR, Vardian ST, Yadegari Z, Adhim M, Saravi NSV. Periostin levels in saliva of patients with chronic periodontitis. J Indian Soc Periodontol. 2018; 22(1):25-7. [DOI:10.10.4103/jisp.jisp_239_17] [PMID] [PMCID]
Kumaresan D, Balasundaram A, Naik VK, Appukuttan DP. Gingival crevicular fluid periostin levels in chronic periodontitis patients following nonsurgical periodontal treatment with low-level laser therapy. Eur J Dent. 2016; 10(4):546-50. [DOI:10.4103/1305-7456.195179] [PMID] [PMCID]
Padial-Molina M, Volk S, Taut A, Giannobile W, Rios H. Periostin is down-regulated during periodontal inflammation. J Dent Res. 2012; 91(11):1078-84. [DOI:10.1177/0022034512459655] [PMID] [PMCID]
Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol. 1999; 4(1):1-6. [DOI:10.1902/annals.1999.4.1.1] [PMID]
Navazesh M. Methods for collecting saliva. Ann N Y Acad Sci. 1993; 694:72-7. [DOI:10.1111/j.1749-6632.1993.tb18343.x] [PMID]
Padial-Molina M, Volk SL, Taut AD, Giannobile WV, Rios HF. Periostin is down-regulated during periodontal inflammation. J Dent Res. 2012; 91(11):1078-84. [DOI:10.1177/0022034512459655] [PMID] [PMCID]
Kruzynska-Frejtag A, Wang J, Maeda M, Rogers R, Krug E, Hoffman S, et al. Periostin is expressed within the developing teeth at the sites of epithelial-mesenchymal interaction. Dev Dyn. 2004; 229(4):857-68. [DOI:10.1002/dvdy.10453] [PMID]
Rios H, Koushik SV, Wang H, Wang J, Zhou HM, Lindsley A, et al. Periostin null mice exhibit dwarfism, incisor enamel defects, and an early-onset periodontal disease-like phenotype. Mol Cell Biol. 2005; 25(24):11131-44. [DOI:10.1128/MCB.25.24.11131-11144.2005] [PMID] [PMCID]
Rios HF, Ma D, Xie Y, Giannobile WV, Bonewald LF, Conway SJ, et al. Periostin is essential for the integrity and function of the periodontal ligament during occlusal loading in mice. J Periodontol. 2008; 79(8):1480-90. [DOI:10.1902/jop.2008.070624] [PMID] [PMCID]
Balli U, Keles ZP, Avci B, Guler S, Cetinkaya BO, Keles GC. Assessment of periostin levels in serum and gingival crevicular fluid of patients with periodontal disease. J Periodontal Res. 2015; 50(6):707-13. [DOI:10.1111/jre.12254] [PMID]
Horiuchi K, Amizuka N, Takeshita S, Takamatsu H, Katsuura M, Ozawa H, et al. Identification and characterization of a novel protein, periostin, with restricted expression to periosteum and periodontal ligament and increased expression by transforming growth factor beta. J Bone Miner Res. 1999; 14(7):1239-49. [DOI:10.1359/jbmr.1999.14.7.1239] [PMID]
Sidhu SS, Yuan S, Innes AL, Kerr S, Woodruff PG, Hou L, et al. Roles of epithelial cell-derived periostin in TGF-beta activation, collagen production, and collagen gel elasticity in asthma. Proc Natl Acad Sci U S A. 2010; 107(32):14170-5. [DOI:10.1073/pnas.1009426107] [PMID] [PMCID]
Nakajima M, Honda T, Miyauchi S, Yamazaki K. Th2 cytokines efficiently stimulate periostin production in gingival fibroblasts but periostin does not induce an inflammatory response in gingival epithelial cells. Arch Oral Biol. 2014; 59(2):93-101. [DOI:10.1016/j.archoralbio.2013.10.004] [PMID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |