دوره 22، شماره 4 - ( مهر و آبان 1398 )
جلد 22 شماره 4 صفحات 65-52 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sofian M, Eghbal E, Ghaznavi-Rad E, Ramezani A, Mohaghegh P. The Effect of Probiotic Yogurt on the Frequency of Clostridium difficile in Old Hospitalized Patients. J Arak Uni Med Sci 2019; 22 (4) :52-65
URL: http://jams.arakmu.ac.ir/article-1-6097-fa.html
URL: http://jams.arakmu.ac.ir/article-1-6097-fa.html
صوفیان معصومه، اقبال الهه، غزنوی راد احسان الله، رمضانی آمیتیس، محقق پگاه. تأثیر ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در بیماران سالمند بستری در بیمارستان. مجله دانشگاه علوم پزشكي اراك. 1398; 22 (4) :52-65
معصومه صوفیان1 

 ، الهه اقبال1
، الهه اقبال1 

 ، احسان الله غزنوی راد2
، احسان الله غزنوی راد2 

 ، آمیتیس رمضانی3
، آمیتیس رمضانی3 

 ، پگاه محقق4
، پگاه محقق4 




 ، الهه اقبال1
، الهه اقبال1 

 ، احسان الله غزنوی راد2
، احسان الله غزنوی راد2 

 ، آمیتیس رمضانی3
، آمیتیس رمضانی3 

 ، پگاه محقق4
، پگاه محقق4 


1- گروه بیماریهای عفونی، مرکز تحقیقات بیماریهای عفونی، داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ اراک، اراک، ایﺮان.
2- گروه میکروبیولوژی، داﻧﺸﮑﺪهﭘﺰﺷﮑﯽ، داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ اراک، اراک، ایﺮان.
3- گروه تحقیقات بالینی، انستیتو پاستور ،تهران، ایﺮان.
4- گروه پزشکی اجتماعی، داﻧﺸﮑﺪه ﭘﺰﺷﮑﯽ، داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ اراک، اراک، ایﺮان.
2- گروه میکروبیولوژی، داﻧﺸﮑﺪهﭘﺰﺷﮑﯽ، داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ اراک، اراک، ایﺮان.
3- گروه تحقیقات بالینی، انستیتو پاستور ،تهران، ایﺮان.
4- گروه پزشکی اجتماعی، داﻧﺸﮑﺪه ﭘﺰﺷﮑﯽ، داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ اراک، اراک، ایﺮان.
متن کامل [PDF 3482 kb]
(1767 دریافت)
| چکیده (HTML) (5704 مشاهده)
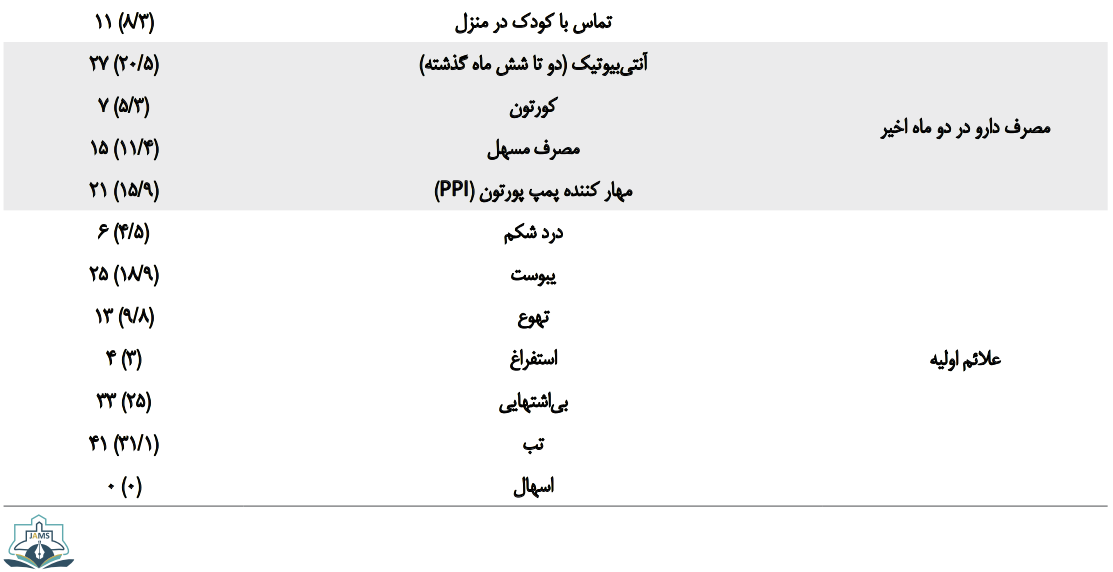
بر اساس جدول شماره 1، از 132 بیمار بررسیشده، 43/2 درصد مبتلا به فشار خون، 28 درصد مبتلا به دیابت و 26/5 درصد مبتلا به بیماری مزمن تنفسی بودند.
هیچ یک از دو گروه سابقه کلونوسکوپی و بستری در بخش مراقبت ویژه در سه ماه اخیر نداشتند. در بررسی علائم اولیه بیماران، از 132 بیمار بررسیشده 31/1 درصد دارای تب، 25 درصد بیاشتهایی و 18/9 درصد یبوست داشتند. هیچ یک از بیماران مبتلا به اسهال نبودند.
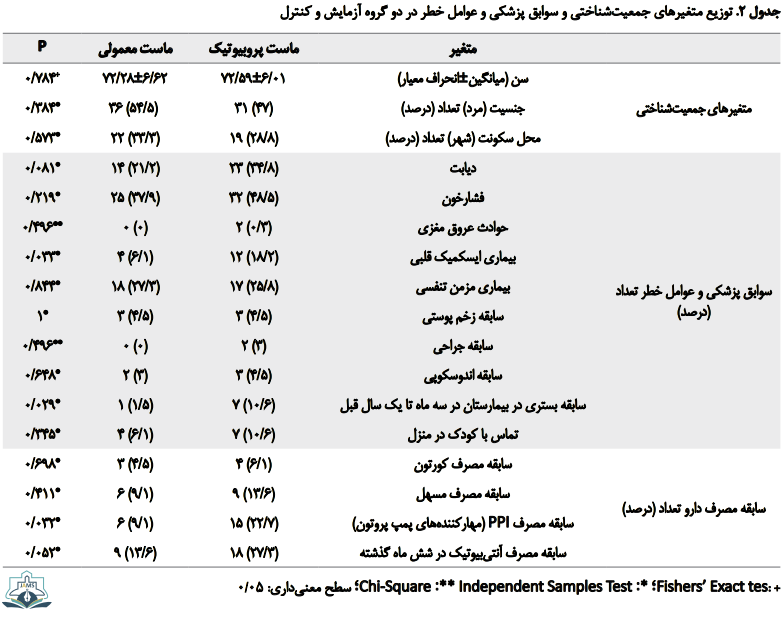
در جدول شماره 2، توزیع سوابق پزشکی، مشخصات جمعیتشناختی و تاریخچه دارویی بیمار به تفکیک دو گروه آزمایش و کنترل ذکر شده است. بر اساس تستهای آماری ذکرشده در ذیل جدول شماره 2، سابقه بیماری ایسکمیک قلبی (0/033=P)، سابقه بستری در بیمارستان در سه ماه تا یک سال قبل (0/029=P)، سابقه مصرف PPI (مهارکنندههای پمپ پروتون) (0/032=P) و سابقه مصرف آنتیبیوتیک در شش ماه گذشته (0/052=P) در ابتدای مطالعه در دو گروه، تفاوت معنیداری داشت.
بر اساس آزمون آماری خی دو طبق جدول شماره ۳، شیوع تب (0/039=P) و یبوست (0/046=P) در ابتدای مطالعه در گروه آزمایش بیشتر بوده است و این تفاوت از نظر آماری معنیدار است. بر اساس آزمون آماری فیشر، بین بروز کلستریدیوم دیفیسیل مثبت و سن، جنس، محل سکونت، سابقه جراحی، سابقه اندوسکوپی، زخم پوستی و مصرف مسهل تفاوت آماری معنیدار دیده نشد(P≥0/05) . در مقایسه موارد کلستریدیوم دیفیسیل مثبت و منفی در شروع مطالعه بر اساس آزمون دقیق فیشر، علائمی نظیر درد شکم، یبوست، استفراغ و بیاشتهایی در دو گروه تفاوت معنیدار نداشتند، ولی در موارد مثبت، فراوانی نسبی تب بیشتر بود و بر اساس آزمون دقیق فیشر این تفاوت شیوع از نظر آماری معنیدار است (0/002=P).
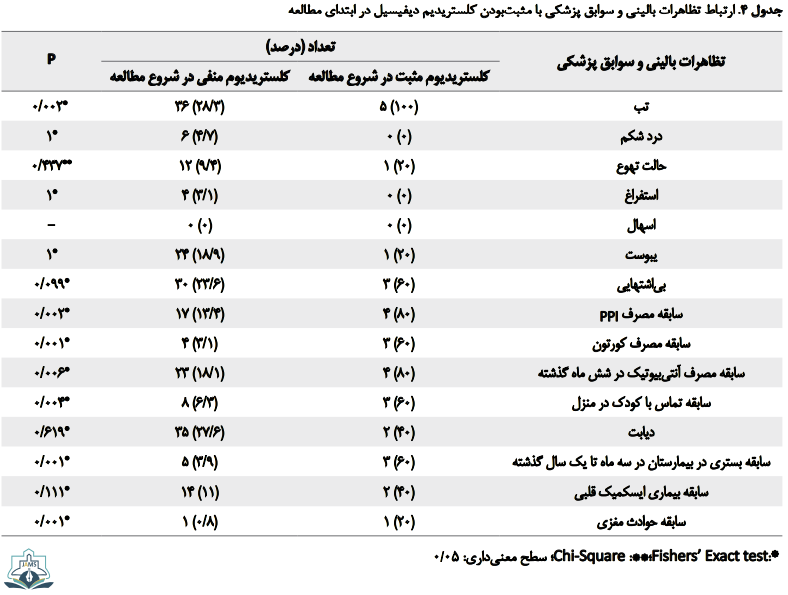
در بررسی سوابق پزشکی و دارویی بیمار، سابقه مصرف کورتون (0/001=P)، مصرف آنتیبیوتیک در شش ماه گذشته (0/006=P)، مهارکننده پمپ پروتون (0/002=P)، سابقه تماس با کودک (0/004=P)، سابقه بستری در بیمارستان (0/001=P) و سابقه حوادث مغزی (0/001=P) در بیماران کلستریدیوم دیفیسیل مثبت بیشتر است و بر اساس آزمون دقیق فیشر، این تفاوت از نظر آماری معنیدار است (جدول شماره 4).
بر اساس رگرسیون لجستیک دوحالته مطابق جدول شماره 5 با (سطح معنیداری: 0/05)، سابقه حوادث مغزیعروقی، سابقه بستری قبلی در بیمارستان در دو ماه گذشته ، تماس با کودکان در منزل، مصرف آنتیبیوتیک در دو ماه گذشته ، سابقه مصرف کورتون و مهارکنندههای پمپ پروتون و وجود تب، ریسکعامل مساعدکننده ابتلا به عفونت کلستریدیوم دیفیسیل بود. نسبت شانس ابتلا به کلستریدیوم دیفیسیل در افراد با سابقه حوادث عروق مغزی 1/69 برابر افراد بدون سابقه ابتلا به حوادث قلبیعروقی است. همچنین سابقه مصرف آنتیبیوتیک در شش ماه گذشته، شانس ابتلا به عفونت کلستریدیوم دیفیسیل را 1/97 برابر افزایش میدهد. نسبت شانس بروز عفونت کلستریدیوم دیفیسیل در افراد با سابقه بستری در بیمارستان، سابقه تماس با کودکان در منزل، مصرف دارو در جدول شماره 5 ذکر شده است. شانس بروز تب در افراد مبتلا به عفونت کلستریدیوم دیفیسیل 1/78 برابر افراد غیرمبتلا به عفونت بود.
بحث
این مطالعه کارآزمایی بالینی تصادفیشده با هدف تعیین تأثیر ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل بر 132 نفر بیمار با میانگین سنی72 سال بستری در بخش عفونی بیمارستان ولیعصر انجام شد. در کل نمونهها، سه بیماری شایع به ترتیب فشار خون بالا، دیابت و بیماری مزمن تنفسی بود. حدود 20/5 درصد بیماران سابقه مصرف آنتیبیوتیک در شش ماه گذشته را داشتند.
شیوع کلستریدیوم دیفیسیل در این مطالعه 3/8 درصد بود و علائمی نظیر درد شکم، یبوست، تهوع و استفراغ و بیاشتهایی همراهی با عفونت مثبت نداشت. ولی در موارد مثبت، فراوانی نسبی تب بیشتر بود. در مطالعات مختلف شیوع توکسین کلستریدیوم دیفیسیل و اسهال ناشی از کلستریدیوم در بیماران بستری در بیمارستان در طیف گستردهای از 0/1 درصد تا 2 درصد گزارش شده است [13-17]. در مطالعه کوهورت اولسن و همکاران نیز در یک پیگیری دهساله، میزان بروز سالانه 1 تا 4 درصد به دست آمد [15]. در مطالعه زرینفر و همکاران در همین بیمارستان بر 195 نفر بیمار بررسیشده14/4 درصد توکسین کلستریدیوم مثبت بودند و تنها 4/1 درصد اسهال ناشی از کلستریدیوم داشتند [14]. در مطالعه پپن و همکاران در فاصله سالهای 1991 تا 2003 شیوع کلستریدیوم دیفیسیل کاهش چشمگیری پیدا کرده است و عموماً جمعیت سالمندی در معرض خطر بیشتر همراه با مرگومیر بیشتر قرار گرفته است [18].
بر اساس نتایج مطالعه حاضر، سابقه مصرف کورتون، مصرف آنتیبیوتیک در شش ماه گذشته، مهارکننده پمپ پروتون، سابقه تماس با کودک، سابقه بستری در بیمارستان و سابقه حوادث مغزی در بیماران کلستریدیوم دیفیسیل مثبت بیشتر است و بر اساس تست دقیق فیشر این تفاوت از نظر آماری معنیدار است. همچنین بر اساس آزمون آماری رگرسیون لجستیک دومتغیره، با احتساب کلستریدیوم دیفیسیل مثبت به عنوان متغیر وابسته، سابقه حوادث مغزیعروقی، بستری در بیمارستان در شش ماه گذشته، تماس با کودکان در منزل، سابقه مصرف آنتیبیوتیک در دو تا شش ماه گذشته، مصرف کورتون، مصرف مهارکنندههای پمپ پروتون و وجود تب، ریسکعامل بیماری بودند. اما سن، جنس، محل سکونت، سابقه جراحی، سابقه اندوسکوپی، زخم پوستی و نوع مصرف آنتیبیوتیک، مصرف مسهل شانس ابتلا به بیماری را افزایش نداد.
در مطالعه ویلکاکس و همکاران، شیوع کلستریدیوم دیفیسیل در بیماران بالای 70 سال بستری در بیمارستان2/1 درصد ذکر شده است و مصرف آنتیبیوتیک در چهار هفته گذشته، بهویژه استفاده همزمان از چند دارو، مصرف سفالوسپورینها و بستری در بیمارستان در شش ماه گذشته ریسکعامل بیماری معرفی شده است، در حالی که تماس با کودکان کوچکتر از دو سال، مصرف مهارکنندههای پمپ پروتون یا مصرف داروهای ضدالتهابی غیراستروئیدی شانس ابتلا را افزایش نداده است [19].
بر اساس مطالعه دیال و همکاران اسهال ناشی از کلستریدیوم در 6.8 درصد بیماران بستری گزارش شد و بر اساس رگرسیون چندمتغیره، مصرف مهارکنندههای پمپ پروتون، نارسایی کلیوی، جنس زن و سابقه بستری در بیمارستان در سه ماه گذشته از عوامل بیماری بودند [20].
بر اساس یافتههای مطالعه مکدونالد و همکاران در 2005، شیوع کلستریدیوم دیفیسیل هفت درصد بیان شده است و استفاده از آنتیبیوتیک عمدهترین عامل خطر شناختهشده برای اسهال مرتبط با کلستریدیوم دیفیسیل در نظر گرفته شد. سایر عوامل خطر مطرحشده شامل بستریشدن در بیمارستان، سن بالا و بیماری شدید بود. عوامل خطر احتمالی مطرحشده در مطالعه شامل مهارکردن اسید معده، تغذیه رودهای، جراحی گوارشی، شیمی درمانی و پیوند سلولهای بنیادی بود [5]. در مطالعه مکدونالد و همکاران آمده است که دو نقش عمده برای آنتیبیوتیکها در پاتوژنز کلستریدیوم د یفیسیل مطرح است اول اینکه آنتیبیوتیکها فلور نرمال روده را از بین میبرند و شرایط را برای مخفیشدن کلستریدیوم دیفیسیل و ایجاد توکسینهای آن فراهم میکنند، ثانیاً به نظر میرسد افزایش مقاومت آنتیبیوتیکی کلستریدیوم دیفیسیل به انواع آنتیبیوتیکها کلیندامایسین و فلوروکینولونها نقش مهمی در افزایش ویرولانس آن داشته باشد [5]. آنتیبیوتیکهایی که نقش عمدهای در مستعدکردن میزبان به اسهال مرتبط به کلستریدیوم دیفیسیل دارند، شامل فلوروکینولونها، کلیندامایسین، طیف وسیعی از پنیسیلینها و سفالوسپورینها هستند. هر آنتیبیوتیکی حتی مترونیدازول و وانکومایسین که در درمان کلستریدیوم دیفیسیل نقش دارند میتوانند کولیت وابسته به آنتیبیوتیک ایجاد کنند. استفاده گسترده از آنتیبیوتیکها، استفاده از چندین آنتیبیوتیک و افزایش دوره درمان با آنتیبیوتیک، از عواملی هستند که شیوع اسهال ناشی از کلستریدیوم دیفیسیل را افزایش میدهند [5، 21].
طبق نتایج مطالعه فریمن و همکاران در بررسی اپیدمیولوژیک عفونت کلستریدیوم به این نتیجه رسیدند که استفاده روزافزون از تکنیک تشخیصی ریبوتایپ PCR منجر به افزایش آمار تشخیصی شده و همزمان تغییرات شگرفی در درمان، عوارض و پیامدهای بیماری شده است [22].
در این مطالعه گروه سنی سالمندان بررسی شده بود. بر اساس مطالعه ریگ و همکاران در سال 2007 ، سن بالا با افزایش شدت اسهال مرتبط با کلستریدیوم دیفیسیل رابطه داشت [23]. علت این ارتباط نامشخص و شاید چندعاملی باشد. عوامل مربوط به میزبان شامل پاسخ ایمنی به عفونت کلستریدیوم دیفیسیل و بیماریهای همراه سالمندی از جمله این علل است [8، 17، 23].
در مطالعه ما همه بیماران آنتیبیوتیک سفتریاکسون و آزیترومایسین مصرف میکردند و بنابراین امکان بررسی نقش نوع آنتیبیوتیک بر بروز کلستریدیوم دفیسیل نبود. بر اساس مطالعه آرونسون و همکاران، سفالوسپورینها قویترین عامل آنتیمیکروبیال همراه با کلستریدیوم دیفیسیل معرفی شدهاند [24]. نتایج مطالعه هاول و همکاران نشان داد مصرف مهارکنندههای پمپ پروتون خطر ابتلا به عفونت کلستریدیوم دیفیسیل را 0/9 درصد تا 1/4درصد افزایش میدهد. در حالی که مصرف آنتیاسید این خطر را به میزان 0/6درصد بالا میبرد [25]. در مطالعه حاضر هم، مصرف مهارکنندههای پمپ پروتون از ریسکعوامل بیماری بود، ولی مصرف منیزیوم هیدروکساید، شانس ابتلا را افزایش نداد. ساندرا و همکاران در مطالعه خود به این نتیجه رسیدند اسیدیته معده مهمترین سازوکار دفاعی بدن در برابرکلونیزاسیون پاتوژنهای بلعشده است و مصرف ساپرسکنندههای اسید معده نظیر مهارکنندههای پمپ پروتون با افزایش PH معده و تأثیر بر عملکرد لوکوسیتها همزمان با افزایش شانس ابتلا به عفونتهای تنفسی، باعث افزایش شانس عفونتهای رودهای نیز میشوند [20]. کانینگهام و همکاران نیز، استفاده وسیع از آنتیبیوتیکها و مصرف بیش از هشت هفتهای مهارکنندههای پمپ پروتون را عامل خطر کلستریدیوم دیفیسیل بیان کردهاند [26].
متن کامل: (8404 مشاهده)
مقدمه
کلستریدیوم دیفیسیل یک باسیل غیرهوازی گرم مثبت، اسپوردار، تولیدکننده توکسین است که اولین بار در سال 1935 کشف شد. این باکتری میتواند به شکل اسپور و شکل وژتاتیو (رویشی) وجود داشته باشد. اسپورها در مقابل حرارت، اسید و آنتیبیوتیکها مقاوماند و در کولون به فرم وژتاتیو تبدیل و به شکل تولیدکننده توکسین در میآیند. کلستریدیوم دیفیسیل جزء فلور روده در نوزادان سالم به حساب میآیند [1، 2]. نقش آسیبشناختی کلستریدیوم اولین بار در سال 1970 مشخص شد، هنگامی که توکسین کلستریدیوم دیفیسیل در مدفوع بیماران با کولیت سودوممبران (با غشای کاذب) در ارتباط با آنتیبیوتیک کشف شد. این ارگانیسم تازه در آن زمان به عنوان عامل کولیت پسودوممبران و اسهال و کولیت در بیمارانی که در معرض آنتیبیوتیک بودند شناخته شد [1، 2].
کلستریدیوم دیفیسیل با ایجاد دو اگزوتوکسین موجب کولیت و اسهال میشود: توکسین A (انتروتوکسین) و توکسین B (سایتوتوکسین) [3]. توکسین A موجب التهاب میشود که این التهاب به ترشح مایعات رودهای، آسیب مخاطی و التهاب منجر میشود. توکسین B تقریباً 10 برابر بیشتر از توکسین نوع A در آسیب مخاط کولونی نقش دارد. گونههایی که توکسین نوع A را ندارند، میتوانند از نظر ویرولانس مشابه گونههایی باشند که هر دو نوع توکسین را دارند. تعداد کمی از گونههای کلستریدیوم دیفیسیل توکسین تولید نمیکنند. این گونهها میتوانند در دستگاه گوارش رشد و تکثیر شده و جزء فلور نرمال شوند و بیماریزا نیستند [1، 4، 5].
عفونت کلستریدیوم دیفیسیل ناشی از باسیل کلستریدیوم دیفیسیل اسپوردار گرم مثبت و بیهوازی است که توکسینهای A و B و Binary toxin تولید میکند و اسپور آن در محیط، بهخصوص بیمارستانها و مراکز نگهداری موجود است [1]. این توکسینها فرایندهایی را ایجاد میکنند که موجب اختلال عملکرد اپیتلیال، اسهال و تشکیل غشای کاذب میشود. مرگومیر نسبتدادهشده به عفونت کلستریدیوم دیفیسیل قبلاً معادل 0/6-3/5 بوده و در همهگیریهای اخیر به 6/9 رسیده است و با افزایش سن به صورت پیشروندهای بیشتر میشود [3]. به طور معمول کمتر از 5 درصد بزرگسالان با کلستریدیوم دیفیسیل کولینیزه هستند که این رقم در بیماران پس از بستری در بیمارستان به 20 تا 30 درصد میرسد، حتی میتواند کولیت فولمینانت بدهد که نیاز به مداخله جراحی دارد و در سالهای اخیر شیوع و شدت عفونت کلستریدیوم دیفیسیل در اروپا و آمریکا افزایش یافته است که در سالهای اخیر شیوع و شدت عفونت کلستریدیوم دیفیسیل در اروپا و آمریکا افزایش یافته است که موجب افزایش ناخوشی و مرگومیر و افزایش ضریب اشغال تختهای بیمارستانی شده است [1].
کلیندامایسین، آمپیسیلین، آموکسیسیلین و سفالوسپورینها اولین آنتیبیوتیکهایی بودند که با CDI همراهی داشتهاند. سفالوسپورینها نسل دو و سه بهخصوص سفتریاکسون، سفوتاکسیم، سفوروکسیم، سفتازیدیم، داروهایی هستند که بیش از همه مسئول این وضعیت هستند و فلوروکینولونها (سیپروفلوکساسین، لووفلوکساسین، موکسی فلوکساسین) جدیدترین دسته داروهای مسبب این بیماری در همهگیریهای اخیر هستند، با وجود این، تمام آنتیبیوتیکها حتی وانکومایسین و مترونیدازول که برای درمان CDI به کار میروند، خطر CDI را دربر دارند [3].
از طرفی پروبیوتیکها ارگانیسمهای زندهای هستند که با تعدیل فلور میکروبی روده، اثرات مفیدی بر سلامت میزبان اعمال میکنند [6]. سازوکار اثر پروبیوتیکها کاملاً شناختهشده نیست، ولی مکانیسمهایی برای توجیه اثرات پیشگیریکننده و درمانی آنها در بیماریهای انسان پیشنهاد شده است که از آن جمله میتوان به تولید ترکیبات مهارکننده باکتریها، تعدیل PH روده، بلوک جایگاههای اتصال باکتریها، رقابت برای جذب مواد غذایی و تقویت سیستم ایمنی اشاره کرد [6، 7]. پروبیوتیکها، ریززندههایی (باکتریها و مخمرهایی) هستند که با استقرار در بخشهای مختلف بدن (اساساً روده به عنوان فلور طبیعی)، از طریق دریافت خوراکی یا کارگذاری موضعی، با عمل زیستی خود، از طریق حفظ و بهبود توازن فلور میکروبی روده (میان ریززندههای سودمند و زیانبخش)، سبب ایجاد خواص سلامتبخش برای میزبان میشوند [6، 7]. گوناگونی ریززندههای پروبیوتیک همواره در حال افزایش بوده است، بدین معنا که پژوهشهای نوین به شناخت نژادها، گونهها و جنسهای جدیدی از ریززندهها که خواص پروبیوتیکی دارند، منجر میشود [6، 7].
درصد قابل توجهی از بیماران بستری در بخشهای عفونی، افراد سالمندی هستند که نیاز به درمان آنتی بیوتیکی به صورت طولانی مدت دارند [8، 9]. افزایش کلونیزاسیون کلستریدیوم دیفیسیل در این بیماران و درمان عفونت کلستریدیوم دیفیسیل با آنتیبیوتیکهایی مثل مترونیدازول و وانکومایسین خود با خطر عفونت کلستریدیوم دیفیسیل همراه است [10-12]. مصرف ماست پروبیوتیک با خواص ذکرشده میتواند از رشد کلستریدیوم دیفسیل که عامل عمده موارد اسهال بیمارستانی، کولیت و کولیت سودوممبرانوس است، جلوگیری کرده و باعث کاهش موربیتی و حتی مورتالیتی این بیماران شود [7]. در میان مطالعات انجامشده در خصوص اثر پروبیوتیکها بر عفونت کلستریدیوم دیفیسیل، تعداد مطالعاتی که به بررسی اثر پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در گروه سنی سالمندان پرداختهاند، ناچیز است. بنابراین این پژوهش با هدف بررسی اثر مصرف ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در بیماران سالمند بستری در بخش عفونی بیمارستان ولیعصر اراک انجام شد.
مواد و روشها
در این مطالعه کارآزمایی بالینی تصادفیشده دوسوکور ، تعداد 132 بیمار بالای60 سال که با تشخیص پنومونی اکتسابی در بخش عفونی بیمارستان ولیعصر شهر اراک بستری و تحت درمان آنتیبیوتیکی با سفتریاکسون و آزیترومایسین بودند، به شیوه دردسترس انتخاب شدند. پروتکل مطالعه برای بیماران توضیح داده شد و بیماران فرمهای رضایتنامه آگاهانه را تکمیل کردند. بیماران به صورت تصادفی به دو گروه 66نفره آزمایش و کنترل تقسیم شدند.
معیارهای ورود به مطالعه شامل سن بیشتر از 60 سال، درمان با آنتیبیوتیک سفتریاکسون و آزیترومایسین ، دریافتنکردن آنتیبیوتیک در دو ماه گذشته، کسب رضایت شرکت در مطالعه توسط بیمار، مبتلانبودن به HIV و نبود اسهال در هنگام بستریشدن بود. معیارهای خروج از مطالعه شامل تمایلنداشتن بیمار برای شرکت در مطالعه یا ناتوانی در اجرای دستورها، ترخیص بیمار قبل از هفت روز، ابتلا به HIV و نیاز به بستری در ICU بود.
بیماران گروه آزمایش از روز اول بستری 200 سیسی ماست پروبیوتیک در دو نوبت نهار و شام دریافت کرده و بیماران گروه کنترل نیز از روز اول بستری 200 سیسی ماست معمولی در دو نوبت نهار و شام دریافت میکردند. با هماهنگی کارشناس تغذیه بیمارستان، ماست پروبیوتیک کاله کمچرب با حفظ زنجیره سرما و توضیح چگونگی سرو ماست در پیالههای ماستخوری معمول بیمارستان که از لحاظ ظاهری، تفاوتی با سرو ماست معمولی نداشت و فقط با نام ماست یک و ماست دو تهیه و توزیع شد و تا تکمیل حجم نمونه ادامه یافت. با هماهنگی با واحد آزمایشگاه در روز اول و هشتم بستری، نمونه مدفوع یا سوآپ رکتال توسط دستیار اخذ و با حفظ شرایط به آزمایشگاه منتقل میشد. از نمونه مدفوع تمامی افرادی که وارد طرح میشدند، به میزان دو گرم به طور مستقیم در محیط PBS برای استخراج DNA برده شده و در فریزر C°20 نگهداری میشدند. برای انجام واکنش زنجیرهای پلیمراز برای ژنهای مطالعهشده در ابتدا DNA توسط کیت یکتاتجهیز مستقیماً از نمونه مدفوع استخراج شد. محصولات PCR برای تعیین توالی نوکلئوتیدی به شرکت ژن فناوران ارسال شد و نتایج تحلیل BCAST حاکی از ناحیه توکسینهای A و B کلستریدیوم دیفیسیل بود. برای اینکه ثابت کنیم اسید نوکلئیک باکتری در نمونه استخراجشده ما هست، یک PCR برای 16SRNA انجام دادیم. برای اطمینان از استخراج DNA، از نانودراپ مؤسسه واکسن و سرمسازی رازی اراک و پرایمرهای 16srRNAUniversal باکتریایی استفاده شد.
پس از جمعآوری دادهها و ورود به محیط نرمافزار آماری SPSS (نسخه ۱۶) با استفاده از تستهای آماری مناسب کای اسکویر، تست دقیق فیشر و تیتست مستقل دادهها تجزیه و تحلیل شدند. برای توصیف دادههای کمی از میانگین و انحراف معیار و برای توصیف دادههای کیفی از تعداد و درصد استفاده شد. سطح خطای نوع اول 05/0 لحاظ شد.
یافتهها
در این مطالعه کارآزمایی بالینی تصادفیشده که با هدف تعیین تاثیر ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در بیماران بستری در بخش عفونی بیمارستان ولیعصر انجام شد، دو گروه 66 نفره از بیماران واجد شرایط ورود به مطالعه، به مدت 8 روز متوالی، 200 گرم ماست پروبیوتیک (گروه آزمایش) یا ماست معمولی (گروه کنترل) در دو نوبت دریافت کردند. هر دو گروه به شکل 100 درصد تحتدرمان با سفتریاکسون وآزیترومایسین بودند و هیچ یک وانکومایسین یا مروپنم یا سیپروفلوکساسین دریافت نمیکردند.
در کل نمونهها، میانگین و انحراف معیار سن در افراد مورد بررسیشده 6/30±72/43 سال بود. از کل بیماران موردمطالعه 67 نفر (50/8 درصد) مرد بودند. در بررسی محل سکونت بیماران، 41 نفر (31/1 درصد) ساکن شهر بودند. از 132 بیمار بررسیشده، عفونت کلستریدیوم در پنج بیمار (3/8 درصد) مثبت بود. شیوع علائم اولیه و سوابق پزشکی و دارویی در کل نمونهها در جدول شماره 1 بیان شده است.
کلستریدیوم دیفیسیل یک باسیل غیرهوازی گرم مثبت، اسپوردار، تولیدکننده توکسین است که اولین بار در سال 1935 کشف شد. این باکتری میتواند به شکل اسپور و شکل وژتاتیو (رویشی) وجود داشته باشد. اسپورها در مقابل حرارت، اسید و آنتیبیوتیکها مقاوماند و در کولون به فرم وژتاتیو تبدیل و به شکل تولیدکننده توکسین در میآیند. کلستریدیوم دیفیسیل جزء فلور روده در نوزادان سالم به حساب میآیند [1، 2]. نقش آسیبشناختی کلستریدیوم اولین بار در سال 1970 مشخص شد، هنگامی که توکسین کلستریدیوم دیفیسیل در مدفوع بیماران با کولیت سودوممبران (با غشای کاذب) در ارتباط با آنتیبیوتیک کشف شد. این ارگانیسم تازه در آن زمان به عنوان عامل کولیت پسودوممبران و اسهال و کولیت در بیمارانی که در معرض آنتیبیوتیک بودند شناخته شد [1، 2].
کلستریدیوم دیفیسیل با ایجاد دو اگزوتوکسین موجب کولیت و اسهال میشود: توکسین A (انتروتوکسین) و توکسین B (سایتوتوکسین) [3]. توکسین A موجب التهاب میشود که این التهاب به ترشح مایعات رودهای، آسیب مخاطی و التهاب منجر میشود. توکسین B تقریباً 10 برابر بیشتر از توکسین نوع A در آسیب مخاط کولونی نقش دارد. گونههایی که توکسین نوع A را ندارند، میتوانند از نظر ویرولانس مشابه گونههایی باشند که هر دو نوع توکسین را دارند. تعداد کمی از گونههای کلستریدیوم دیفیسیل توکسین تولید نمیکنند. این گونهها میتوانند در دستگاه گوارش رشد و تکثیر شده و جزء فلور نرمال شوند و بیماریزا نیستند [1، 4، 5].
عفونت کلستریدیوم دیفیسیل ناشی از باسیل کلستریدیوم دیفیسیل اسپوردار گرم مثبت و بیهوازی است که توکسینهای A و B و Binary toxin تولید میکند و اسپور آن در محیط، بهخصوص بیمارستانها و مراکز نگهداری موجود است [1]. این توکسینها فرایندهایی را ایجاد میکنند که موجب اختلال عملکرد اپیتلیال، اسهال و تشکیل غشای کاذب میشود. مرگومیر نسبتدادهشده به عفونت کلستریدیوم دیفیسیل قبلاً معادل 0/6-3/5 بوده و در همهگیریهای اخیر به 6/9 رسیده است و با افزایش سن به صورت پیشروندهای بیشتر میشود [3]. به طور معمول کمتر از 5 درصد بزرگسالان با کلستریدیوم دیفیسیل کولینیزه هستند که این رقم در بیماران پس از بستری در بیمارستان به 20 تا 30 درصد میرسد، حتی میتواند کولیت فولمینانت بدهد که نیاز به مداخله جراحی دارد و در سالهای اخیر شیوع و شدت عفونت کلستریدیوم دیفیسیل در اروپا و آمریکا افزایش یافته است که در سالهای اخیر شیوع و شدت عفونت کلستریدیوم دیفیسیل در اروپا و آمریکا افزایش یافته است که موجب افزایش ناخوشی و مرگومیر و افزایش ضریب اشغال تختهای بیمارستانی شده است [1].
کلیندامایسین، آمپیسیلین، آموکسیسیلین و سفالوسپورینها اولین آنتیبیوتیکهایی بودند که با CDI همراهی داشتهاند. سفالوسپورینها نسل دو و سه بهخصوص سفتریاکسون، سفوتاکسیم، سفوروکسیم، سفتازیدیم، داروهایی هستند که بیش از همه مسئول این وضعیت هستند و فلوروکینولونها (سیپروفلوکساسین، لووفلوکساسین، موکسی فلوکساسین) جدیدترین دسته داروهای مسبب این بیماری در همهگیریهای اخیر هستند، با وجود این، تمام آنتیبیوتیکها حتی وانکومایسین و مترونیدازول که برای درمان CDI به کار میروند، خطر CDI را دربر دارند [3].
از طرفی پروبیوتیکها ارگانیسمهای زندهای هستند که با تعدیل فلور میکروبی روده، اثرات مفیدی بر سلامت میزبان اعمال میکنند [6]. سازوکار اثر پروبیوتیکها کاملاً شناختهشده نیست، ولی مکانیسمهایی برای توجیه اثرات پیشگیریکننده و درمانی آنها در بیماریهای انسان پیشنهاد شده است که از آن جمله میتوان به تولید ترکیبات مهارکننده باکتریها، تعدیل PH روده، بلوک جایگاههای اتصال باکتریها، رقابت برای جذب مواد غذایی و تقویت سیستم ایمنی اشاره کرد [6، 7]. پروبیوتیکها، ریززندههایی (باکتریها و مخمرهایی) هستند که با استقرار در بخشهای مختلف بدن (اساساً روده به عنوان فلور طبیعی)، از طریق دریافت خوراکی یا کارگذاری موضعی، با عمل زیستی خود، از طریق حفظ و بهبود توازن فلور میکروبی روده (میان ریززندههای سودمند و زیانبخش)، سبب ایجاد خواص سلامتبخش برای میزبان میشوند [6، 7]. گوناگونی ریززندههای پروبیوتیک همواره در حال افزایش بوده است، بدین معنا که پژوهشهای نوین به شناخت نژادها، گونهها و جنسهای جدیدی از ریززندهها که خواص پروبیوتیکی دارند، منجر میشود [6، 7].
درصد قابل توجهی از بیماران بستری در بخشهای عفونی، افراد سالمندی هستند که نیاز به درمان آنتی بیوتیکی به صورت طولانی مدت دارند [8، 9]. افزایش کلونیزاسیون کلستریدیوم دیفیسیل در این بیماران و درمان عفونت کلستریدیوم دیفیسیل با آنتیبیوتیکهایی مثل مترونیدازول و وانکومایسین خود با خطر عفونت کلستریدیوم دیفیسیل همراه است [10-12]. مصرف ماست پروبیوتیک با خواص ذکرشده میتواند از رشد کلستریدیوم دیفسیل که عامل عمده موارد اسهال بیمارستانی، کولیت و کولیت سودوممبرانوس است، جلوگیری کرده و باعث کاهش موربیتی و حتی مورتالیتی این بیماران شود [7]. در میان مطالعات انجامشده در خصوص اثر پروبیوتیکها بر عفونت کلستریدیوم دیفیسیل، تعداد مطالعاتی که به بررسی اثر پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در گروه سنی سالمندان پرداختهاند، ناچیز است. بنابراین این پژوهش با هدف بررسی اثر مصرف ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در بیماران سالمند بستری در بخش عفونی بیمارستان ولیعصر اراک انجام شد.
مواد و روشها
در این مطالعه کارآزمایی بالینی تصادفیشده دوسوکور ، تعداد 132 بیمار بالای60 سال که با تشخیص پنومونی اکتسابی در بخش عفونی بیمارستان ولیعصر شهر اراک بستری و تحت درمان آنتیبیوتیکی با سفتریاکسون و آزیترومایسین بودند، به شیوه دردسترس انتخاب شدند. پروتکل مطالعه برای بیماران توضیح داده شد و بیماران فرمهای رضایتنامه آگاهانه را تکمیل کردند. بیماران به صورت تصادفی به دو گروه 66نفره آزمایش و کنترل تقسیم شدند.
معیارهای ورود به مطالعه شامل سن بیشتر از 60 سال، درمان با آنتیبیوتیک سفتریاکسون و آزیترومایسین ، دریافتنکردن آنتیبیوتیک در دو ماه گذشته، کسب رضایت شرکت در مطالعه توسط بیمار، مبتلانبودن به HIV و نبود اسهال در هنگام بستریشدن بود. معیارهای خروج از مطالعه شامل تمایلنداشتن بیمار برای شرکت در مطالعه یا ناتوانی در اجرای دستورها، ترخیص بیمار قبل از هفت روز، ابتلا به HIV و نیاز به بستری در ICU بود.
بیماران گروه آزمایش از روز اول بستری 200 سیسی ماست پروبیوتیک در دو نوبت نهار و شام دریافت کرده و بیماران گروه کنترل نیز از روز اول بستری 200 سیسی ماست معمولی در دو نوبت نهار و شام دریافت میکردند. با هماهنگی کارشناس تغذیه بیمارستان، ماست پروبیوتیک کاله کمچرب با حفظ زنجیره سرما و توضیح چگونگی سرو ماست در پیالههای ماستخوری معمول بیمارستان که از لحاظ ظاهری، تفاوتی با سرو ماست معمولی نداشت و فقط با نام ماست یک و ماست دو تهیه و توزیع شد و تا تکمیل حجم نمونه ادامه یافت. با هماهنگی با واحد آزمایشگاه در روز اول و هشتم بستری، نمونه مدفوع یا سوآپ رکتال توسط دستیار اخذ و با حفظ شرایط به آزمایشگاه منتقل میشد. از نمونه مدفوع تمامی افرادی که وارد طرح میشدند، به میزان دو گرم به طور مستقیم در محیط PBS برای استخراج DNA برده شده و در فریزر C°20 نگهداری میشدند. برای انجام واکنش زنجیرهای پلیمراز برای ژنهای مطالعهشده در ابتدا DNA توسط کیت یکتاتجهیز مستقیماً از نمونه مدفوع استخراج شد. محصولات PCR برای تعیین توالی نوکلئوتیدی به شرکت ژن فناوران ارسال شد و نتایج تحلیل BCAST حاکی از ناحیه توکسینهای A و B کلستریدیوم دیفیسیل بود. برای اینکه ثابت کنیم اسید نوکلئیک باکتری در نمونه استخراجشده ما هست، یک PCR برای 16SRNA انجام دادیم. برای اطمینان از استخراج DNA، از نانودراپ مؤسسه واکسن و سرمسازی رازی اراک و پرایمرهای 16srRNAUniversal باکتریایی استفاده شد.
پس از جمعآوری دادهها و ورود به محیط نرمافزار آماری SPSS (نسخه ۱۶) با استفاده از تستهای آماری مناسب کای اسکویر، تست دقیق فیشر و تیتست مستقل دادهها تجزیه و تحلیل شدند. برای توصیف دادههای کمی از میانگین و انحراف معیار و برای توصیف دادههای کیفی از تعداد و درصد استفاده شد. سطح خطای نوع اول 05/0 لحاظ شد.
یافتهها
در این مطالعه کارآزمایی بالینی تصادفیشده که با هدف تعیین تاثیر ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل در بیماران بستری در بخش عفونی بیمارستان ولیعصر انجام شد، دو گروه 66 نفره از بیماران واجد شرایط ورود به مطالعه، به مدت 8 روز متوالی، 200 گرم ماست پروبیوتیک (گروه آزمایش) یا ماست معمولی (گروه کنترل) در دو نوبت دریافت کردند. هر دو گروه به شکل 100 درصد تحتدرمان با سفتریاکسون وآزیترومایسین بودند و هیچ یک وانکومایسین یا مروپنم یا سیپروفلوکساسین دریافت نمیکردند.
در کل نمونهها، میانگین و انحراف معیار سن در افراد مورد بررسیشده 6/30±72/43 سال بود. از کل بیماران موردمطالعه 67 نفر (50/8 درصد) مرد بودند. در بررسی محل سکونت بیماران، 41 نفر (31/1 درصد) ساکن شهر بودند. از 132 بیمار بررسیشده، عفونت کلستریدیوم در پنج بیمار (3/8 درصد) مثبت بود. شیوع علائم اولیه و سوابق پزشکی و دارویی در کل نمونهها در جدول شماره 1 بیان شده است.
بر اساس جدول شماره 1، از 132 بیمار بررسیشده، 43/2 درصد مبتلا به فشار خون، 28 درصد مبتلا به دیابت و 26/5 درصد مبتلا به بیماری مزمن تنفسی بودند.
هیچ یک از دو گروه سابقه کلونوسکوپی و بستری در بخش مراقبت ویژه در سه ماه اخیر نداشتند. در بررسی علائم اولیه بیماران، از 132 بیمار بررسیشده 31/1 درصد دارای تب، 25 درصد بیاشتهایی و 18/9 درصد یبوست داشتند. هیچ یک از بیماران مبتلا به اسهال نبودند.
در جدول شماره 2، توزیع سوابق پزشکی، مشخصات جمعیتشناختی و تاریخچه دارویی بیمار به تفکیک دو گروه آزمایش و کنترل ذکر شده است. بر اساس تستهای آماری ذکرشده در ذیل جدول شماره 2، سابقه بیماری ایسکمیک قلبی (0/033=P)، سابقه بستری در بیمارستان در سه ماه تا یک سال قبل (0/029=P)، سابقه مصرف PPI (مهارکنندههای پمپ پروتون) (0/032=P) و سابقه مصرف آنتیبیوتیک در شش ماه گذشته (0/052=P) در ابتدای مطالعه در دو گروه، تفاوت معنیداری داشت.
بر اساس آزمون آماری خی دو طبق جدول شماره ۳، شیوع تب (0/039=P) و یبوست (0/046=P) در ابتدای مطالعه در گروه آزمایش بیشتر بوده است و این تفاوت از نظر آماری معنیدار است. بر اساس آزمون آماری فیشر، بین بروز کلستریدیوم دیفیسیل مثبت و سن، جنس، محل سکونت، سابقه جراحی، سابقه اندوسکوپی، زخم پوستی و مصرف مسهل تفاوت آماری معنیدار دیده نشد(P≥0/05) . در مقایسه موارد کلستریدیوم دیفیسیل مثبت و منفی در شروع مطالعه بر اساس آزمون دقیق فیشر، علائمی نظیر درد شکم، یبوست، استفراغ و بیاشتهایی در دو گروه تفاوت معنیدار نداشتند، ولی در موارد مثبت، فراوانی نسبی تب بیشتر بود و بر اساس آزمون دقیق فیشر این تفاوت شیوع از نظر آماری معنیدار است (0/002=P).
در بررسی سوابق پزشکی و دارویی بیمار، سابقه مصرف کورتون (0/001=P)، مصرف آنتیبیوتیک در شش ماه گذشته (0/006=P)، مهارکننده پمپ پروتون (0/002=P)، سابقه تماس با کودک (0/004=P)، سابقه بستری در بیمارستان (0/001=P) و سابقه حوادث مغزی (0/001=P) در بیماران کلستریدیوم دیفیسیل مثبت بیشتر است و بر اساس آزمون دقیق فیشر، این تفاوت از نظر آماری معنیدار است (جدول شماره 4).
بر اساس رگرسیون لجستیک دوحالته مطابق جدول شماره 5 با (سطح معنیداری: 0/05)، سابقه حوادث مغزیعروقی، سابقه بستری قبلی در بیمارستان در دو ماه گذشته ، تماس با کودکان در منزل، مصرف آنتیبیوتیک در دو ماه گذشته ، سابقه مصرف کورتون و مهارکنندههای پمپ پروتون و وجود تب، ریسکعامل مساعدکننده ابتلا به عفونت کلستریدیوم دیفیسیل بود. نسبت شانس ابتلا به کلستریدیوم دیفیسیل در افراد با سابقه حوادث عروق مغزی 1/69 برابر افراد بدون سابقه ابتلا به حوادث قلبیعروقی است. همچنین سابقه مصرف آنتیبیوتیک در شش ماه گذشته، شانس ابتلا به عفونت کلستریدیوم دیفیسیل را 1/97 برابر افزایش میدهد. نسبت شانس بروز عفونت کلستریدیوم دیفیسیل در افراد با سابقه بستری در بیمارستان، سابقه تماس با کودکان در منزل، مصرف دارو در جدول شماره 5 ذکر شده است. شانس بروز تب در افراد مبتلا به عفونت کلستریدیوم دیفیسیل 1/78 برابر افراد غیرمبتلا به عفونت بود.
بحث
این مطالعه کارآزمایی بالینی تصادفیشده با هدف تعیین تأثیر ماست پروبیوتیک بر فراوانی کلستریدیوم دیفیسیل بر 132 نفر بیمار با میانگین سنی72 سال بستری در بخش عفونی بیمارستان ولیعصر انجام شد. در کل نمونهها، سه بیماری شایع به ترتیب فشار خون بالا، دیابت و بیماری مزمن تنفسی بود. حدود 20/5 درصد بیماران سابقه مصرف آنتیبیوتیک در شش ماه گذشته را داشتند.
شیوع کلستریدیوم دیفیسیل در این مطالعه 3/8 درصد بود و علائمی نظیر درد شکم، یبوست، تهوع و استفراغ و بیاشتهایی همراهی با عفونت مثبت نداشت. ولی در موارد مثبت، فراوانی نسبی تب بیشتر بود. در مطالعات مختلف شیوع توکسین کلستریدیوم دیفیسیل و اسهال ناشی از کلستریدیوم در بیماران بستری در بیمارستان در طیف گستردهای از 0/1 درصد تا 2 درصد گزارش شده است [13-17]. در مطالعه کوهورت اولسن و همکاران نیز در یک پیگیری دهساله، میزان بروز سالانه 1 تا 4 درصد به دست آمد [15]. در مطالعه زرینفر و همکاران در همین بیمارستان بر 195 نفر بیمار بررسیشده14/4 درصد توکسین کلستریدیوم مثبت بودند و تنها 4/1 درصد اسهال ناشی از کلستریدیوم داشتند [14]. در مطالعه پپن و همکاران در فاصله سالهای 1991 تا 2003 شیوع کلستریدیوم دیفیسیل کاهش چشمگیری پیدا کرده است و عموماً جمعیت سالمندی در معرض خطر بیشتر همراه با مرگومیر بیشتر قرار گرفته است [18].
بر اساس نتایج مطالعه حاضر، سابقه مصرف کورتون، مصرف آنتیبیوتیک در شش ماه گذشته، مهارکننده پمپ پروتون، سابقه تماس با کودک، سابقه بستری در بیمارستان و سابقه حوادث مغزی در بیماران کلستریدیوم دیفیسیل مثبت بیشتر است و بر اساس تست دقیق فیشر این تفاوت از نظر آماری معنیدار است. همچنین بر اساس آزمون آماری رگرسیون لجستیک دومتغیره، با احتساب کلستریدیوم دیفیسیل مثبت به عنوان متغیر وابسته، سابقه حوادث مغزیعروقی، بستری در بیمارستان در شش ماه گذشته، تماس با کودکان در منزل، سابقه مصرف آنتیبیوتیک در دو تا شش ماه گذشته، مصرف کورتون، مصرف مهارکنندههای پمپ پروتون و وجود تب، ریسکعامل بیماری بودند. اما سن، جنس، محل سکونت، سابقه جراحی، سابقه اندوسکوپی، زخم پوستی و نوع مصرف آنتیبیوتیک، مصرف مسهل شانس ابتلا به بیماری را افزایش نداد.
در مطالعه ویلکاکس و همکاران، شیوع کلستریدیوم دیفیسیل در بیماران بالای 70 سال بستری در بیمارستان2/1 درصد ذکر شده است و مصرف آنتیبیوتیک در چهار هفته گذشته، بهویژه استفاده همزمان از چند دارو، مصرف سفالوسپورینها و بستری در بیمارستان در شش ماه گذشته ریسکعامل بیماری معرفی شده است، در حالی که تماس با کودکان کوچکتر از دو سال، مصرف مهارکنندههای پمپ پروتون یا مصرف داروهای ضدالتهابی غیراستروئیدی شانس ابتلا را افزایش نداده است [19].
بر اساس مطالعه دیال و همکاران اسهال ناشی از کلستریدیوم در 6.8 درصد بیماران بستری گزارش شد و بر اساس رگرسیون چندمتغیره، مصرف مهارکنندههای پمپ پروتون، نارسایی کلیوی، جنس زن و سابقه بستری در بیمارستان در سه ماه گذشته از عوامل بیماری بودند [20].
بر اساس یافتههای مطالعه مکدونالد و همکاران در 2005، شیوع کلستریدیوم دیفیسیل هفت درصد بیان شده است و استفاده از آنتیبیوتیک عمدهترین عامل خطر شناختهشده برای اسهال مرتبط با کلستریدیوم دیفیسیل در نظر گرفته شد. سایر عوامل خطر مطرحشده شامل بستریشدن در بیمارستان، سن بالا و بیماری شدید بود. عوامل خطر احتمالی مطرحشده در مطالعه شامل مهارکردن اسید معده، تغذیه رودهای، جراحی گوارشی، شیمی درمانی و پیوند سلولهای بنیادی بود [5]. در مطالعه مکدونالد و همکاران آمده است که دو نقش عمده برای آنتیبیوتیکها در پاتوژنز کلستریدیوم د یفیسیل مطرح است اول اینکه آنتیبیوتیکها فلور نرمال روده را از بین میبرند و شرایط را برای مخفیشدن کلستریدیوم دیفیسیل و ایجاد توکسینهای آن فراهم میکنند، ثانیاً به نظر میرسد افزایش مقاومت آنتیبیوتیکی کلستریدیوم دیفیسیل به انواع آنتیبیوتیکها کلیندامایسین و فلوروکینولونها نقش مهمی در افزایش ویرولانس آن داشته باشد [5]. آنتیبیوتیکهایی که نقش عمدهای در مستعدکردن میزبان به اسهال مرتبط به کلستریدیوم دیفیسیل دارند، شامل فلوروکینولونها، کلیندامایسین، طیف وسیعی از پنیسیلینها و سفالوسپورینها هستند. هر آنتیبیوتیکی حتی مترونیدازول و وانکومایسین که در درمان کلستریدیوم دیفیسیل نقش دارند میتوانند کولیت وابسته به آنتیبیوتیک ایجاد کنند. استفاده گسترده از آنتیبیوتیکها، استفاده از چندین آنتیبیوتیک و افزایش دوره درمان با آنتیبیوتیک، از عواملی هستند که شیوع اسهال ناشی از کلستریدیوم دیفیسیل را افزایش میدهند [5، 21].
طبق نتایج مطالعه فریمن و همکاران در بررسی اپیدمیولوژیک عفونت کلستریدیوم به این نتیجه رسیدند که استفاده روزافزون از تکنیک تشخیصی ریبوتایپ PCR منجر به افزایش آمار تشخیصی شده و همزمان تغییرات شگرفی در درمان، عوارض و پیامدهای بیماری شده است [22].
در این مطالعه گروه سنی سالمندان بررسی شده بود. بر اساس مطالعه ریگ و همکاران در سال 2007 ، سن بالا با افزایش شدت اسهال مرتبط با کلستریدیوم دیفیسیل رابطه داشت [23]. علت این ارتباط نامشخص و شاید چندعاملی باشد. عوامل مربوط به میزبان شامل پاسخ ایمنی به عفونت کلستریدیوم دیفیسیل و بیماریهای همراه سالمندی از جمله این علل است [8، 17، 23].
در مطالعه ما همه بیماران آنتیبیوتیک سفتریاکسون و آزیترومایسین مصرف میکردند و بنابراین امکان بررسی نقش نوع آنتیبیوتیک بر بروز کلستریدیوم دفیسیل نبود. بر اساس مطالعه آرونسون و همکاران، سفالوسپورینها قویترین عامل آنتیمیکروبیال همراه با کلستریدیوم دیفیسیل معرفی شدهاند [24]. نتایج مطالعه هاول و همکاران نشان داد مصرف مهارکنندههای پمپ پروتون خطر ابتلا به عفونت کلستریدیوم دیفیسیل را 0/9 درصد تا 1/4درصد افزایش میدهد. در حالی که مصرف آنتیاسید این خطر را به میزان 0/6درصد بالا میبرد [25]. در مطالعه حاضر هم، مصرف مهارکنندههای پمپ پروتون از ریسکعوامل بیماری بود، ولی مصرف منیزیوم هیدروکساید، شانس ابتلا را افزایش نداد. ساندرا و همکاران در مطالعه خود به این نتیجه رسیدند اسیدیته معده مهمترین سازوکار دفاعی بدن در برابرکلونیزاسیون پاتوژنهای بلعشده است و مصرف ساپرسکنندههای اسید معده نظیر مهارکنندههای پمپ پروتون با افزایش PH معده و تأثیر بر عملکرد لوکوسیتها همزمان با افزایش شانس ابتلا به عفونتهای تنفسی، باعث افزایش شانس عفونتهای رودهای نیز میشوند [20]. کانینگهام و همکاران نیز، استفاده وسیع از آنتیبیوتیکها و مصرف بیش از هشت هفتهای مهارکنندههای پمپ پروتون را عامل خطر کلستریدیوم دیفیسیل بیان کردهاند [26].
در مطالعه ما هیچیک از بیماران کولونوسکوپی نشده بودند و آندوسکوپی نیز ریسکعامل بیماری نبود. در مطالعه رودمان و همکاران شیوع اسهال ناشی از کلستریدیوم در بیماران مبتلا به بیماریهای التهابی روده بیش از دو برابر افراد سالم بود و به همین نسبت، شانس بستری در بیمارستان و انجام مداخلات تشخیصی و درمانی، نظیر آندوسکوپی و کولونوسکوپی بیشتر بود [27]. در مطالعه لویس و همکاران با عنوان تأثیر پریبیوتیک اولیگوفروکتوز بر عود اسهال ناشی از کلستریدیوم،کاهش چشمگیر عود اسهال و مدت بستری کمتر در بیمارستان گزارش شده است [28]. عوامل خطری نظیر سن بیشتر از 65 سال، بیماری وخیم زمینهای نظیر حوادث قلبیعروقی یا مزمن تنفسی، اقدامات تهاجمی دستگاه گوارش نظیر آندوسکوپی و لوله معدهای، مسهلها و دارودرمانی زخم معده، سابقه بستری در بیمارستان و یا بخش مراقبتهای ویژه و تنقیه باریم عموماً با تهاجم به مخاط دفاعی دستگاه گوارشی و تغییر در فلور طبیعی آن به افزایش خطر ابتلا به عفونت کلستریدیوم منجر شده و شانس مواجهه با عامل بیماری را افزایش میدهد [4].
در مطالعه ما نسبت کاهش بروز کلستریدیوم دیفیسیل مثبت در روز هشتم مطالعه به نسبت زمان ورود به مطالعه وجود داشت، ولی از نظر آماری این کاهش بین دو گروه معنیدار نبود. همچنین ماست پروبیوتیک نتوانسته بود بر علائم و عوارض مصرف آنتیبیوتیک نسبت به گروه شاهد تغییری ایجاد کند. طبق نتایج مطالعه زرینفر و همکاران نیز استفاده از پروبیوتیک لاکتوباسیلوس تأثیر معنیداری بر کاهش اسهال ناشی از آنتیبیوتیکها نداشت، اگرچه علائم را تخفیف داده بود. کارآزماییهای بالینی محدودی در خصوص بررسی تأثیر پروبیوتیکها بر کلستریدیوم دیفیسیل وجود دارد و این موضوع همچنان نیاز به تحقیق گسترده دارد [13]. در مطالعه سانگ و همکاران که از پروبیوتیک باسیلوس کواگولانس در بیماران تحتدرمان با آنتیبیوتیک استفاده کردند، نتایجی مشابه مطالعه حاضر به دست آمد. در مطالعه کارآزمایی بالینی که توماس و همکاران انجام دادند، از لاکتوباسیلوس کازئی، لاکتو باسیلوس بولگاریکوس و ساکارومایسیز ترموفیلوس استفاده شده بود که کولیت و اسهال ناشی از آنتیبیوتیکها کاهش یافت [29، 30]. بنابراین به نظر میرسد نوع پروبیوتیک بهکاررفته در این موضوع تأثیر داشته باشد.
نتیجهگیری
طبق نتایج مطالعه حاضر استفاده از ماست پروبیوتیک در مقایسه با ماست معمولی تأثیر معنیداری در کاهش شیوع کلستریدیوم دیفیسیل و علائم کولیت بیماران ندارد. مطالعات چندمرکزی با حجم نمونه بیشتر برای بررسی بیشتر در این خصوص لازم است.
درمجموع مطالعات اندکی با نتایج متناقض در خصوص پروبیوتیکها و کلستریدیوم دیفیسیل وجود دارد که همین موضوع منجر به دشواری مقایسه شد. از محدودیتهای مطالعه حاضر، تعداد کم بیماران کلستریدیوم دیفسیل مثبت در طول مطالعه بود که امکان بررسی اثر پروبیوتیک را محدود میکرد. بنابراین مطالعات با حجم نمونه بیشتر توصیه میشود. همچنین تهیه ماست پروبیوتیک با توجه به امکانات و شرایط موجود در بیمارستان مقدور نبود که پس از بررسی بین ماستهای تولیدی از ماست پروبیوتیک کمچرب کاله با حفظ زنجیره سرما استفاده شد. مدت نسبتاً کوتاه بستری بیماران در بیمارستان، به نوعی بررسی اثر درازمدت ماست پروبیوتیک و اثر آنتیبیوتیک بر کلستریدیوم دیفیسیل را محدود میکرد. وجود تنها یک بیمارستان مرجع در شهر اراک امکان بررسی و نمونهگیری چندمرکزی را محدود میکرد. از این رو پیشنهاد میشود مطالعات وسیعتر با حجم نمونه بیشتر و مدت زمان پیگیری طولانیتر در زمینه تأثیرات پروبیوتیکها بر پیشگیری و کنترل عفونتهای گوارشی ناشی از کلستریدیوم دیفیسیل انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با کد اخلاق 10-165-93 در کمیته اخلاق پژوهش دانشگاه علوم پزشکی اراک تأیید و با کد IRCTID IRCT2016092229915N1 در مرکز ثبت مطالعات کارآزمایی بالینی ثبت شده است.
حامی مالی
این مقاله برگرفته از پایاننامه دکترای تخصصی عفونی دستیار دانشگاه علوم پزشکی اراک، الهه اقبال، است. همچنین معاونت تحقیقات و فناوری دانشگاه علوم پزشکی اراک، تأمین مالی این پژوهش را بر عهده داشتند..
مشارکت نویسندگان
مفهومسازی: معصومه صوفیان، الهه اقبال، پگاه محقق؛ تحقیق و بررسی :الهه اقبال، احسان الله غزنوی راد، آمیتیس رمضانی، معصومه صوفیان؛ ویراستاری و نهاییسازی نوشته: معصوم صوفیان، پگاه محقق. همچنین نویسندگان معیارهای استاندارد نویسندگی را بر اساس پیشنهادهای کمیته بینالمللی ناشران مجلات پزشکی (ICMJE) داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مقاله بر خود لازم میدانند از کارکنان بخش عفونی و آزمایشگاه بیمارستان ولیعصر تشکر و قدردانی کنند که در انجام این پژوهش همکاری کردند.
در مطالعه ما نسبت کاهش بروز کلستریدیوم دیفیسیل مثبت در روز هشتم مطالعه به نسبت زمان ورود به مطالعه وجود داشت، ولی از نظر آماری این کاهش بین دو گروه معنیدار نبود. همچنین ماست پروبیوتیک نتوانسته بود بر علائم و عوارض مصرف آنتیبیوتیک نسبت به گروه شاهد تغییری ایجاد کند. طبق نتایج مطالعه زرینفر و همکاران نیز استفاده از پروبیوتیک لاکتوباسیلوس تأثیر معنیداری بر کاهش اسهال ناشی از آنتیبیوتیکها نداشت، اگرچه علائم را تخفیف داده بود. کارآزماییهای بالینی محدودی در خصوص بررسی تأثیر پروبیوتیکها بر کلستریدیوم دیفیسیل وجود دارد و این موضوع همچنان نیاز به تحقیق گسترده دارد [13]. در مطالعه سانگ و همکاران که از پروبیوتیک باسیلوس کواگولانس در بیماران تحتدرمان با آنتیبیوتیک استفاده کردند، نتایجی مشابه مطالعه حاضر به دست آمد. در مطالعه کارآزمایی بالینی که توماس و همکاران انجام دادند، از لاکتوباسیلوس کازئی، لاکتو باسیلوس بولگاریکوس و ساکارومایسیز ترموفیلوس استفاده شده بود که کولیت و اسهال ناشی از آنتیبیوتیکها کاهش یافت [29، 30]. بنابراین به نظر میرسد نوع پروبیوتیک بهکاررفته در این موضوع تأثیر داشته باشد.
نتیجهگیری
طبق نتایج مطالعه حاضر استفاده از ماست پروبیوتیک در مقایسه با ماست معمولی تأثیر معنیداری در کاهش شیوع کلستریدیوم دیفیسیل و علائم کولیت بیماران ندارد. مطالعات چندمرکزی با حجم نمونه بیشتر برای بررسی بیشتر در این خصوص لازم است.
درمجموع مطالعات اندکی با نتایج متناقض در خصوص پروبیوتیکها و کلستریدیوم دیفیسیل وجود دارد که همین موضوع منجر به دشواری مقایسه شد. از محدودیتهای مطالعه حاضر، تعداد کم بیماران کلستریدیوم دیفسیل مثبت در طول مطالعه بود که امکان بررسی اثر پروبیوتیک را محدود میکرد. بنابراین مطالعات با حجم نمونه بیشتر توصیه میشود. همچنین تهیه ماست پروبیوتیک با توجه به امکانات و شرایط موجود در بیمارستان مقدور نبود که پس از بررسی بین ماستهای تولیدی از ماست پروبیوتیک کمچرب کاله با حفظ زنجیره سرما استفاده شد. مدت نسبتاً کوتاه بستری بیماران در بیمارستان، به نوعی بررسی اثر درازمدت ماست پروبیوتیک و اثر آنتیبیوتیک بر کلستریدیوم دیفیسیل را محدود میکرد. وجود تنها یک بیمارستان مرجع در شهر اراک امکان بررسی و نمونهگیری چندمرکزی را محدود میکرد. از این رو پیشنهاد میشود مطالعات وسیعتر با حجم نمونه بیشتر و مدت زمان پیگیری طولانیتر در زمینه تأثیرات پروبیوتیکها بر پیشگیری و کنترل عفونتهای گوارشی ناشی از کلستریدیوم دیفیسیل انجام شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با کد اخلاق 10-165-93 در کمیته اخلاق پژوهش دانشگاه علوم پزشکی اراک تأیید و با کد IRCTID IRCT2016092229915N1 در مرکز ثبت مطالعات کارآزمایی بالینی ثبت شده است.
حامی مالی
این مقاله برگرفته از پایاننامه دکترای تخصصی عفونی دستیار دانشگاه علوم پزشکی اراک، الهه اقبال، است. همچنین معاونت تحقیقات و فناوری دانشگاه علوم پزشکی اراک، تأمین مالی این پژوهش را بر عهده داشتند..
مشارکت نویسندگان
مفهومسازی: معصومه صوفیان، الهه اقبال، پگاه محقق؛ تحقیق و بررسی :الهه اقبال، احسان الله غزنوی راد، آمیتیس رمضانی، معصومه صوفیان؛ ویراستاری و نهاییسازی نوشته: معصوم صوفیان، پگاه محقق. همچنین نویسندگان معیارهای استاندارد نویسندگی را بر اساس پیشنهادهای کمیته بینالمللی ناشران مجلات پزشکی (ICMJE) داشتند.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان مقاله بر خود لازم میدانند از کارکنان بخش عفونی و آزمایشگاه بیمارستان ولیعصر تشکر و قدردانی کنند که در انجام این پژوهش همکاری کردند.
References
- Efron PA, Mazuski JE. Clostridium difficile colitis. Surg Clin North Am. 2009; 89(2):483-500. [DOI:10.1016/j.suc.2008.09.014] [PMID]
- Alcantara CS, Guerrant RL. Update on Clostridium difficile infection. Curr Gastroenterol Rep. 2000; 2(4):310-4. [DOI:10.1007/s11894-000-0024-x]
- Bujanda L, Cosme A. [Clostridium-difficile-associated diarrhea (Spanish)]. Gastroenterol Hepatol. 2009; 32(1):48-56. [DOI:10.1016/j.gastrohep.2008.02.003] [PMID]
- Brown E, Talbot GH, Axelrod P, Provencher M, Hoegg C. Risk factors for Clostridium difficile toxin-associated diarrhea. Infect Control Hosp Epidemiol. 1990; 11(6):283-90. [DOI:10.2307/30145487] [PMID]
- McDonald LC, Killgore GE, Thompson A, Owens RC Jr, Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of clostridium difficile. N Engl J Med. 2005; 353(23):2433-41. [DOI:10.1056/NEJMoa051590] [PMID]
- Liu Y, Tran DQ, Rhoads JM. Probiotics in disease prevention and treatment. J Clin Pharmacol. 2018; 58 (Suppl. 10):S164-79. [DOI:10.1002/jcph.1121] [PMID] [PMCID]
- Hickson M. Probiotics in the prevention of antibiotic-associated diarrhoea and clostridium difficile infection. Therap Adv Gastroenterol. 2011; 4(3):185-97. [DOI:10.1177/1756283X11399115] [PMID] [PMCID]
- Marley C, El Hahi Y, Ferreira G, Woods L, Ramirez Villaescusa A. Evaluation of a risk score to predict future Clostridium difficile disease using UK primary care and hospital data in clinical practice research datalink. Hum Vaccin Immunother. 2019; 4:1-7. [DOI:10.1080/21645515.2019.1589288] [PMID]
- Pareja Sierra T, Hornillos Calvo M. [Clostridium difficile associated diarrhea in the elderly patient (Spanish)]. Rev Clin Esp. 2007; 207(2):86-90. [DOI:10.1157/13100203] [PMID]
- Kazakova SV, Baggs J, McDonald LC, Yi SH, Hatfield KM, Guh A, et al. Association between antibiotic use and hospital-onset clostridioides difficile infection in US acute care hospitals, 2006-2012: An ecologic analysis. Clin Infect Dis. 2019; pii:ciz169 [DOI:10.1093/cid/ciz169] [PMID]
- Sachu A, Dinesh K, Siyad I, Kumar A, Vasudevan A, Karim S. A prospective cross sectional study of detection of Clostridium difficile toxin in patients with antibiotic associated diarrhoea. Iran J Microbiol. 2018; 10(1):1-6. [PMID] [PMCID]
- Kim G, Zhu NA. Community-acquired Clostridium difficile infection. Can Fam Physician. 2017;63(2):131-2. [PMID] [PMCID]
- Miller M. The fascination with probiotics for Clostridium difficile infection: lack of evidence for prophylactic or therapeutic efficacy. Anaerobe. 2009; 15(6):281-4. [DOI:10.1016/j.anaerobe.2009.08.005] [PMID]
- Zarinfar N, Sarmadian H, Esmaili A. [Effect of probiotic preparation in preventing antibiotic associated diarrhea and colitis: A clinical trial (Persian)]. Iran South Med J. 2014; 17(3):368-76.
- Olson MM, Shanholtzer CJ, Lee JT, Jr., Gerding DN. Ten years of prospective Clostridium difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982-1991.Infect Control Hosp Epidemiol. 1994; 15(6):371-81. [DOI:10.2307/30145589] [PMID]
- Tabaqchali S, Wilks M. Epidemiological aspects of infections caused by bacteroides fragilis and clostridium difficile. Eur J Clin Microbiol Infect Dis. 1992; 11(11):1049-57. [DOI:10.1007/BF01967798] [PMID]
- Moens A, Verstockt B, Machiels K, Bossuyt P, Verdonck A, Lagrou K, et al. Clostridium difficile infection in inflammatory bowel disease: Epidemiology over two decades. Eur J Gastroenterol Hepatol. 2019; 31(6):668-73. [DOI:10.1097/MEG.0000000000001394] [PMID]
- Pepin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: A changing pattern of disease severity. CMAJ. 2004; 171(5):466-72. [DOI:10.1503/cmaj.1041104] [PMID] [PMCID]
- Wilcox MH, Mooney L, Bendall R, Settle CD, Fawley WN. A case-control study of community-associated clostridium difficile infection. J Antimicrob Chemother. 2008; 62(2):388-96. [DOI:10.1093/jac/dkn163] [PMID]
- Dial S, Alrasadi K, Manoukian C, Huang A, Menzies D. Risk of clostridium difficile diarrhea among hospital inpatients prescribed proton pump inhibitors: Cohort and case-control studies. CMAJ. 2004; 171(1):33-8. [DOI:10.1503/cmaj.1040876] [PMID] [PMCID]
- Giannella RA. Antibiotic-associated diarrhea and Clostridium difficile colitis: An update. Rev Esp Enferm Dig. 2001; 93(8):535-43. [PMID]
- Freeman J, Bauer MP, Baines SD, Corver J, Fawley WN, Goorhuis B, et al. The changing epidemiology of clostridium difficile infections. Clin Microbiol Rev. 2010; 23(3):529-49. [DOI:10.1128/CMR.00082-09] [PMID] [PMCID]
- Riggs MM, Sethi AK, Zabarsky TF, Eckstein EC, Jump RL, Donskey CJ. Asymptomatic carriers are a potential source for transmission of epidemic and nonepidemic Clostridium difficile strains among long-term care facility residents. Clin Infect Dis. 2007; 45(8):992-8. [DOI:10.1086/521854] [PMID]
- Aronsson B, Mollby R, Nord CE. Antimicrobial agents and Clostridium difficile in acute enteric disease: Epidemiological data from Sweden, 1980-1982. J Infect Dis. 1985; 151(3):476-81. [DOI:10.1093/infdis/151.3.476] [PMID]
- Howell MD, Novack V, Grgurich P, Soulliard D, Novack L, Pencina M, et al. Iatrogenic gastric acid suppression and the risk of nosocomial clostridium difficile infection. Arch Intern Med. 2010; 170(9):784-90. [DOI:10.1001/archinternmed.2010.89] [PMID]
- Cunningham R, Dale B, Undy B, Gaunt N. Proton pump inhibitors as a risk factor for clostridium difficile diarrhoea. J Hosp Infect. 2003; 54(3):243-5. [DOI:10.1016/S0195-6701(03)00088-4]
- Rodemann JF, Dubberke ER, Reske KA, Seo DH, Stone CD. Incidence of clostridium difficile infection in inflammatory bowel disease. Clin Gastroenterol Hepatol. 2007; 5(3):339-44. [DOI:10.1016/j.cgh.2006.12.027] [PMID]
- Lewis S, Burmeister S, Brazier J. Effect of the prebiotic oligofructose on relapse of clostridium difficile-associated diarrhea: A randomized, controlled study. Clin Gastroenterol Hepatol. 2005; 3(5):442-8. [DOI:10.1016/S1542-3565(04)00677-9]
- Song HJ, Kim JY, Jung SA, Kim SE, Park HS, Jeong Y, et al. Effect of probiotic lactobacillus (Lacidofil ® cap) for the prevention of antibiotic-associated diarrhea: A prospective, randomized, double-blind, multicenter study. J Korean Med Sci. 2010; 25(12):1784-91. [DOI:10.3346/jkms.2010.25.12.1784] [PMID] [PMCID]
- Thomas MR, Litin SC, Osmon DR, Corr AP, Weaver AL, Lohse CM. Lack of effect of lactobacillus GG on antibiotic-associated diarrhea: A randomized, placebo-controlled trial. Mayo Clin Proc. 2001; 76(9):883-9. [DOI:10.4065/76.9.883]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |